よむ、つかう、まなぶ。
資料2-10-2 シルガード9懸濁筋注シリンジ全例登録による強化安全監視活動最終報告書[1.9MB] (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00106.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第102回 7/29)医薬品等安全対策部会安全対策調査会(令和6年度第4回 7/29)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
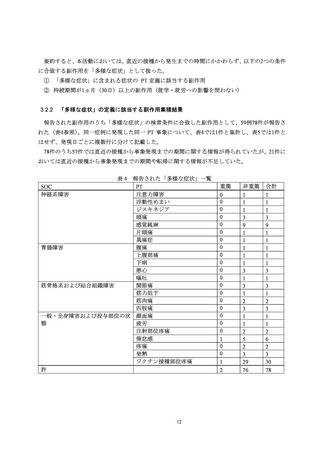
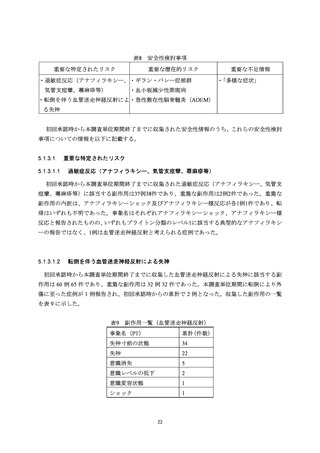
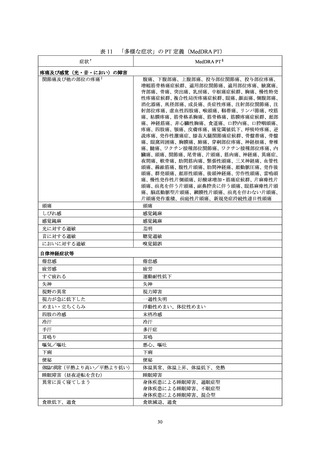
かったとの訴えが被接種者からあったこと及び被接種者が痛みに弱いという印象を接種医がもっ
ていたことから、医師の判断により左臀部への接種が実施された。ワクチン接種部位疼痛は、3回
目の接種当日に発現し、2日後に回復している。なお、本症例は上腕への2回目接種後にワクチン
接種部位の疼痛が発現し、その症状が1ヵ月以上持続したことが報告されており、本活動における
「多様な症状」の発現症例に該当する(表5の No.20)。
5
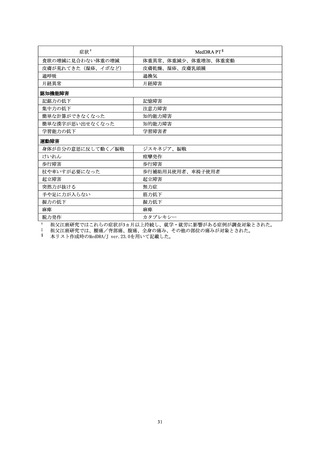
包括的安全性情報
本剤の包括的安全性情報として、本活動への登録の有無に関わらず、最新の安全性定期報告に
該当する第 5 回安全性定期報告(調査単位期間:2022 年 6 月 10 日~2023 年 6 月 9 日)中の“別
紙(5)副作用等の発現状況”の情報を引用して、以下に記載する。
なお、本剤の安全性情報は、副反応検討部会において定期的に検討されており、これまで特段
の懸念事項は挙げられていない。
5.1
副作用
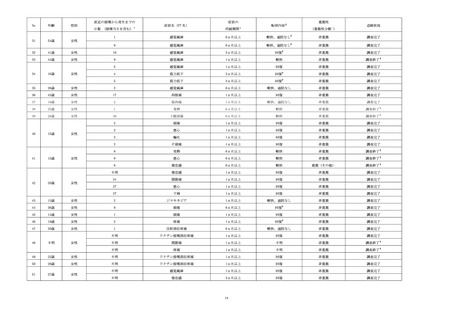
MedDRA/J ver.26.0を用いて集計した。なお、1症例で複数の同一 PT の事象を発現した場合、1
件として集計した。また1症例で複数の事象を発現し、その事象が別々の SOC に属する場合、SOC
ごとに症例数又は件数をカウントした。
副作用の重篤性は医療関係者の意見及び薬機法施行規則第228条の20に基づいて判定し、以下
のいずれかに該当する場合は重篤と評価した。いずれにも該当しないものは非重篤として取り扱
った。
(1) 副作用(不具合)・感染症・有害事象により死に至るもの
(2) 生命を脅かすもの
(3) 永続的又は顕著な障害・機能不全に陥るもの
(4) 入院又は入院期間の延長が必要なもの
(5) 先天異常/出生異常
(6) 報告者により(1)~(5)に掲げる症例に準じて重篤である症例
(7) (1)~(6)に該当しないが企業が重篤と判断した症例
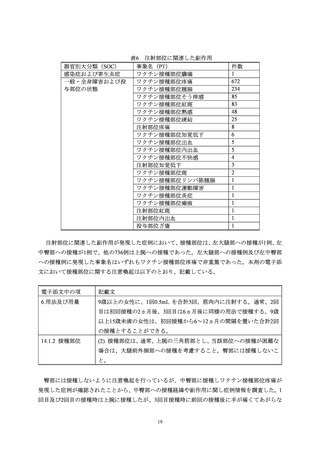
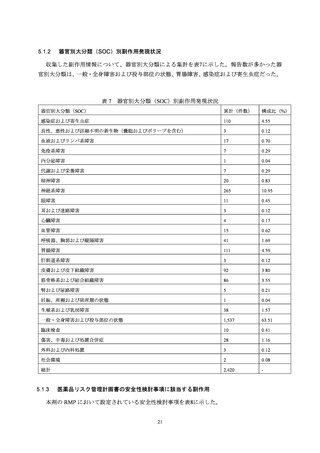
5.1.1
副作用発現状況
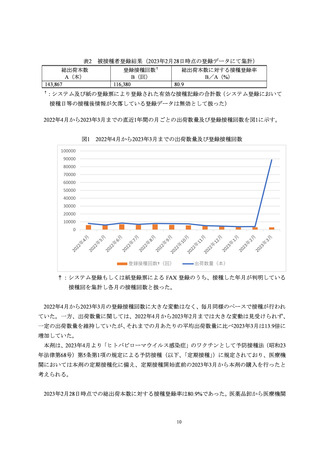
初回承認時から本調査単位期間終了(2023年6月9日)までに1,537例2,736件の有害事象を収集
し、そのうち1,335例2,420件が副作用だった。
なお、これらは日米 EU 医薬品規制調和国際会議(ICH)の E2D 合意事項を参考に、医薬品医
療機器総合機構への報告対象であるか否かを判断できる情報が不足している事象等を除いた数で
ある。
20
ていたことから、医師の判断により左臀部への接種が実施された。ワクチン接種部位疼痛は、3回
目の接種当日に発現し、2日後に回復している。なお、本症例は上腕への2回目接種後にワクチン
接種部位の疼痛が発現し、その症状が1ヵ月以上持続したことが報告されており、本活動における
「多様な症状」の発現症例に該当する(表5の No.20)。
5
包括的安全性情報
本剤の包括的安全性情報として、本活動への登録の有無に関わらず、最新の安全性定期報告に
該当する第 5 回安全性定期報告(調査単位期間:2022 年 6 月 10 日~2023 年 6 月 9 日)中の“別
紙(5)副作用等の発現状況”の情報を引用して、以下に記載する。
なお、本剤の安全性情報は、副反応検討部会において定期的に検討されており、これまで特段
の懸念事項は挙げられていない。
5.1
副作用
MedDRA/J ver.26.0を用いて集計した。なお、1症例で複数の同一 PT の事象を発現した場合、1
件として集計した。また1症例で複数の事象を発現し、その事象が別々の SOC に属する場合、SOC
ごとに症例数又は件数をカウントした。
副作用の重篤性は医療関係者の意見及び薬機法施行規則第228条の20に基づいて判定し、以下
のいずれかに該当する場合は重篤と評価した。いずれにも該当しないものは非重篤として取り扱
った。
(1) 副作用(不具合)・感染症・有害事象により死に至るもの
(2) 生命を脅かすもの
(3) 永続的又は顕著な障害・機能不全に陥るもの
(4) 入院又は入院期間の延長が必要なもの
(5) 先天異常/出生異常
(6) 報告者により(1)~(5)に掲げる症例に準じて重篤である症例
(7) (1)~(6)に該当しないが企業が重篤と判断した症例
5.1.1
副作用発現状況
初回承認時から本調査単位期間終了(2023年6月9日)までに1,537例2,736件の有害事象を収集
し、そのうち1,335例2,420件が副作用だった。
なお、これらは日米 EU 医薬品規制調和国際会議(ICH)の E2D 合意事項を参考に、医薬品医
療機器総合機構への報告対象であるか否かを判断できる情報が不足している事象等を除いた数で
ある。
20