よむ、つかう、まなぶ。
資料2-2 日本製薬工業協会 御提出資料 (35 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2409_04medical/241125/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 11/25)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
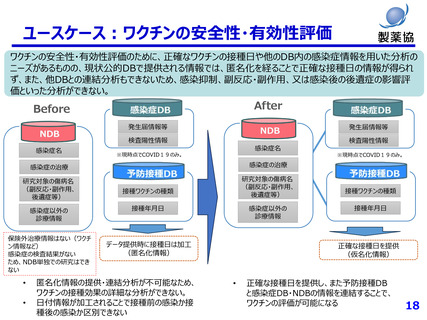
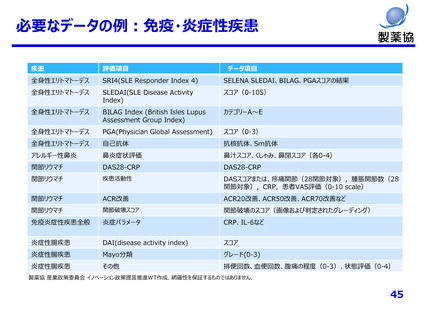
市販後:医薬品の副作用の監視
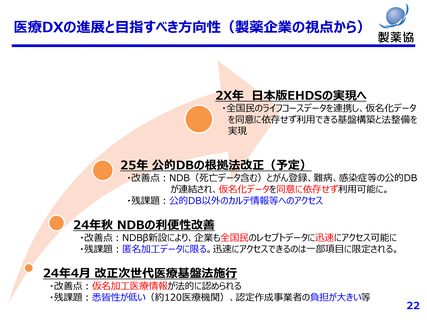
薬害再発防止の観点からも、健康医療データの利活用は有益
異なる情報源からのデータがリンク可
能となりかつデータのバリデーションが可
能となるような仕組みがない限り、その
有用性は極めて限定的なものになる
ため(中略)電子カルテ等のデータ
へのリンクを可能とし、高度な分析へ
の活用を可能にすることの検討も行
う必要がある。
「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」
H22.4.28, P.57より抜粋
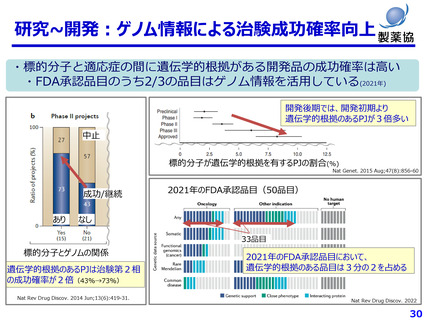
MID-NET単体で確認検証できる副作用リスクは限定的
例えば、 ・発がん性リスクは転院後も長期にわたる観察が必要
・併用リスクは同時期での別の医療機関のデータとの連結が必要
・催奇形性は妊産婦レジストリ等と電子カルテ情報との連結が必要
つながる医療データが増えるほど、特定できる副作用リスクも増える
35
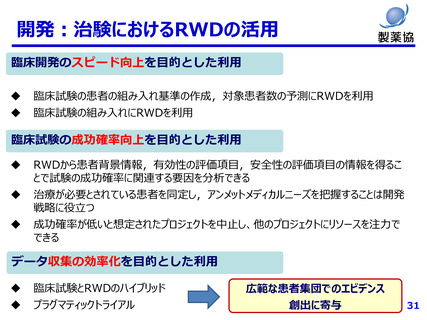
薬害再発防止の観点からも、健康医療データの利活用は有益
異なる情報源からのデータがリンク可
能となりかつデータのバリデーションが可
能となるような仕組みがない限り、その
有用性は極めて限定的なものになる
ため(中略)電子カルテ等のデータ
へのリンクを可能とし、高度な分析へ
の活用を可能にすることの検討も行
う必要がある。
「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」
H22.4.28, P.57より抜粋
MID-NET単体で確認検証できる副作用リスクは限定的
例えば、 ・発がん性リスクは転院後も長期にわたる観察が必要
・併用リスクは同時期での別の医療機関のデータとの連結が必要
・催奇形性は妊産婦レジストリ等と電子カルテ情報との連結が必要
つながる医療データが増えるほど、特定できる副作用リスクも増える
35