よむ、つかう、まなぶ。
資料2-2 日本製薬工業協会 御提出資料 (43 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2409_04medical/241125/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 11/25)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
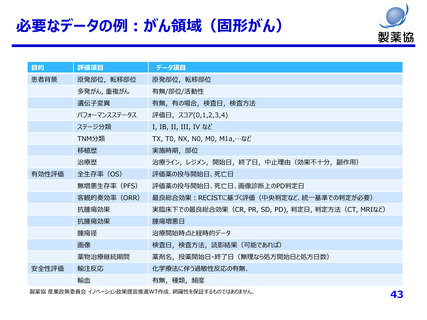
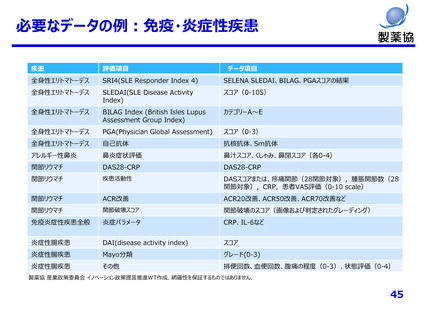
必要なデータの例:がん領域(固形がん)
目的
評価項目
データ項目
患者背景
原発部位,転移部位
原発部位,転移部位
多発がん, 重複がん
有無/部位/活動性
遺伝子変異
有無,有の場合,検査日,検査方法
パフォーマンスステータス
評価日,スコア(0,1,2,3,4)
ステージ分類
I, IB, II, III, IV など
TNM分類
TX, T0, NX, N0, M0, M1a,…など
移植歴
実施時期,部位
治療歴
治療ライン,レジメン,開始日,終了日,中止理由(効果不十分,副作用)
全生存率(OS)
評価薬の投与開始日、死亡日
無増悪生存率(PFS)
評価薬の投与開始日、死亡日、画像診断上のPD判定日
客観的奏効率(ORR)
最良総合効果:RECISTに基づく評価(中央判定など、統一基準での判定が必要)
抗腫瘍効果
実臨床下での最良総合効果(CR, PR, SD, PD), 判定日, 判定方法(CT, MRIなど)
抗腫瘍効果
腫瘍増悪日
腫瘍径
治療開始時点と経時的データ
画像
検査日,検査方法,読影結果(可能であれば)
薬物治療継続期間
薬剤名,投薬開始日・終了日(無理なら処方開始日と処方日数)
輸注反応
化学療法に伴う過敏性反応の有無、
輸血
有無,種類,頻度
有効性評価
安全性評価
製薬協 産業政策委員会 イノベーション政策提言推進WT作成. 網羅性を保証するものではありません.
43
目的
評価項目
データ項目
患者背景
原発部位,転移部位
原発部位,転移部位
多発がん, 重複がん
有無/部位/活動性
遺伝子変異
有無,有の場合,検査日,検査方法
パフォーマンスステータス
評価日,スコア(0,1,2,3,4)
ステージ分類
I, IB, II, III, IV など
TNM分類
TX, T0, NX, N0, M0, M1a,…など
移植歴
実施時期,部位
治療歴
治療ライン,レジメン,開始日,終了日,中止理由(効果不十分,副作用)
全生存率(OS)
評価薬の投与開始日、死亡日
無増悪生存率(PFS)
評価薬の投与開始日、死亡日、画像診断上のPD判定日
客観的奏効率(ORR)
最良総合効果:RECISTに基づく評価(中央判定など、統一基準での判定が必要)
抗腫瘍効果
実臨床下での最良総合効果(CR, PR, SD, PD), 判定日, 判定方法(CT, MRIなど)
抗腫瘍効果
腫瘍増悪日
腫瘍径
治療開始時点と経時的データ
画像
検査日,検査方法,読影結果(可能であれば)
薬物治療継続期間
薬剤名,投薬開始日・終了日(無理なら処方開始日と処方日数)
輸注反応
化学療法に伴う過敏性反応の有無、
輸血
有無,種類,頻度
有効性評価
安全性評価
製薬協 産業政策委員会 イノベーション政策提言推進WT作成. 網羅性を保証するものではありません.
43