よむ、つかう、まなぶ。
資料4-2 ワクチンの安全性に関する評価について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
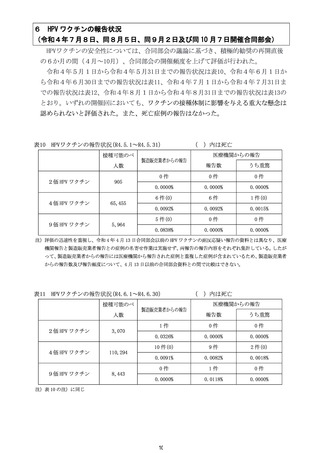
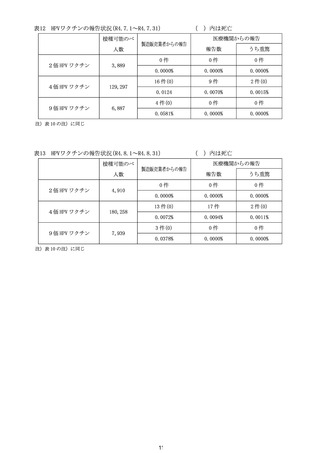
令和4年12月1日
令和4年度第3回
医薬品等安全対策部会
資料3-2 別添1
第 81 回厚生科学審議会予防接種・ワクチン分科会副反応検
討部会、令和4年度第6回薬事・食品衛生審議会薬事分科会
医薬品等安全対策部会安全対策調査会
資料1-9
2022(令和4)年7月8日
ヌバキソビッド筋注接種後の心筋炎等について
令和4年7月8日
医薬安全対策課
1.品目概要
[一 般 名]組換えコロナウイルス(SARS-CoV-2)ワクチン
[販 売 名]ヌバキソビッド筋注
[承認取得者]武田薬品工業株式会社
[効 能 又 は 効 果]SARS-CoV-2 による感染症の予防
2.概要
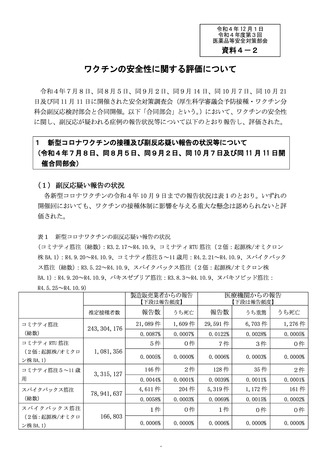
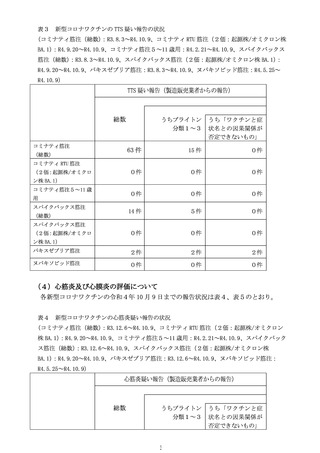
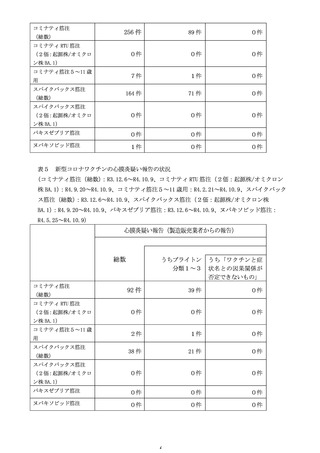
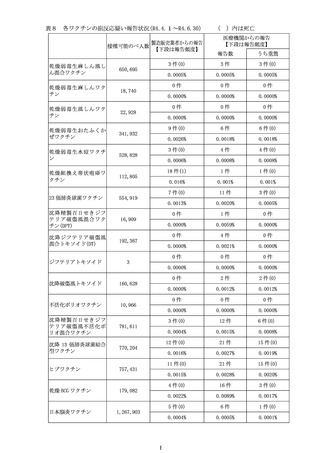
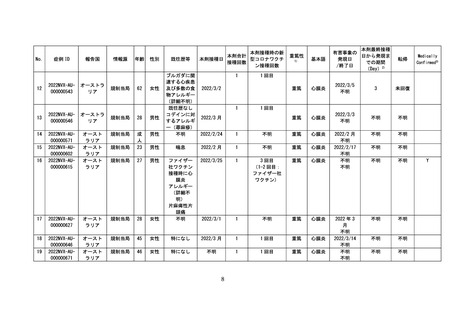
○新型コロナワクチンの副反応が疑われる症状については、個別症例の因果関
係評価の結果や、集積した副反応疑い事例を用いて集団として解析する方法、
海外の規制当局のステートメントなどの情報を総合的に勘案し、継続的に新
たな注意喚起の必要性を検討している。
○ヌバキソビッド筋注(以下、「本剤」という。)については、本邦においては、
令和4年5月 25 日に接種が開始されており、今回の集計対象期間(令和4年
6月 12 日まで)に 11,333 回接種されている。副反応疑い報告においては、現
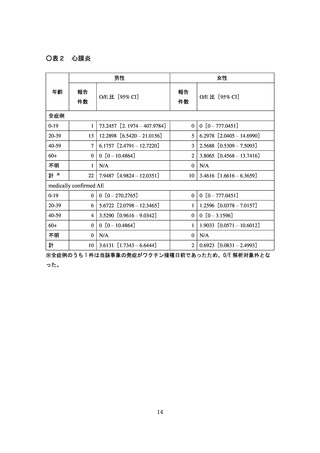
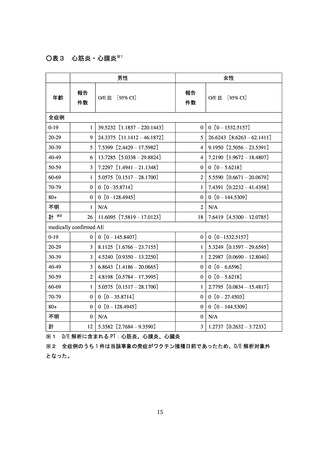
時点で、「心筋炎又は心膜炎(以下、「心筋炎等」という。)」の報告はない。
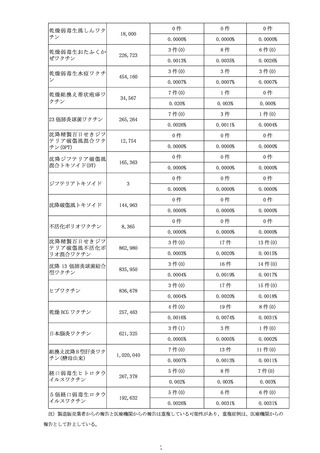
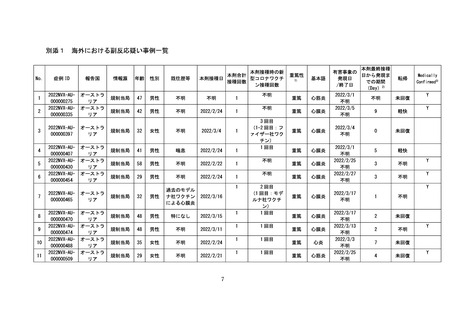
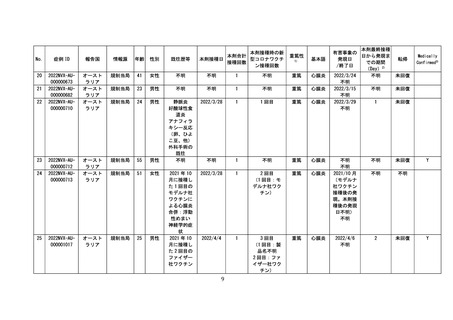
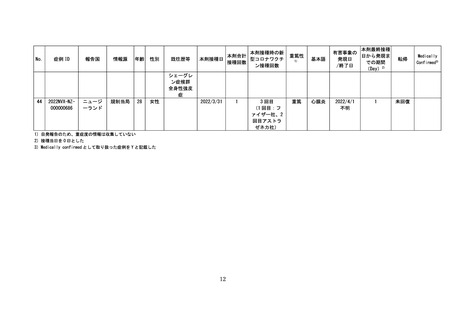
○全世界で 2022 年5月 31 日までに 942,554 回接種されており(うち、2022 年
5月1日~2022 年5月 31 日の期間は 192,902 回)、海外においては、心筋炎
疑い事例は 10 件、心膜炎疑い事例は 33 件が報告されている。一方で、医療関
係者から報告され、医学的に確認されたと考えられる副反応疑い事例※(以下、
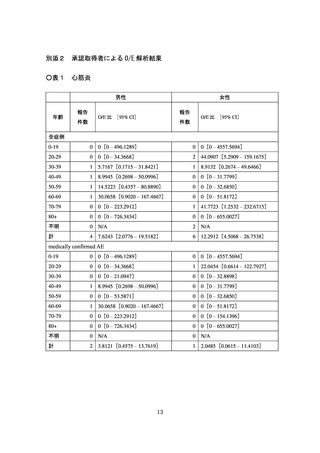
「medically confirmed AE」という。)については、心筋炎疑い事例は3件、
心膜炎疑い事例は 12 件であった。
※:medically confirmed AE の定義は以下のとおり。
1. 医師、歯科医師、薬剤師、看護師、検死官、その他各国の規制で定められた医学的資格を有する者に
より報告又は確認された症例。
2. 患者(被接種者)が副反応発現に関して、それを裏付ける医療記録を提供した場合。
3. 患者(被接種者)が複数の副反応を報告した場合、少なくとも 1 つの副反応に対し医学的な確認を受
けた場合。
4. 医学的資格を有する患者、友人、患者の親族又は介護者が報告した場合。
5. 全ての文献報告
1
令和4年度第3回
医薬品等安全対策部会
資料3-2 別添1
第 81 回厚生科学審議会予防接種・ワクチン分科会副反応検
討部会、令和4年度第6回薬事・食品衛生審議会薬事分科会
医薬品等安全対策部会安全対策調査会
資料1-9
2022(令和4)年7月8日
ヌバキソビッド筋注接種後の心筋炎等について
令和4年7月8日
医薬安全対策課
1.品目概要
[一 般 名]組換えコロナウイルス(SARS-CoV-2)ワクチン
[販 売 名]ヌバキソビッド筋注
[承認取得者]武田薬品工業株式会社
[効 能 又 は 効 果]SARS-CoV-2 による感染症の予防
2.概要
○新型コロナワクチンの副反応が疑われる症状については、個別症例の因果関
係評価の結果や、集積した副反応疑い事例を用いて集団として解析する方法、
海外の規制当局のステートメントなどの情報を総合的に勘案し、継続的に新
たな注意喚起の必要性を検討している。
○ヌバキソビッド筋注(以下、「本剤」という。)については、本邦においては、
令和4年5月 25 日に接種が開始されており、今回の集計対象期間(令和4年
6月 12 日まで)に 11,333 回接種されている。副反応疑い報告においては、現
時点で、「心筋炎又は心膜炎(以下、「心筋炎等」という。)」の報告はない。
○全世界で 2022 年5月 31 日までに 942,554 回接種されており(うち、2022 年
5月1日~2022 年5月 31 日の期間は 192,902 回)、海外においては、心筋炎
疑い事例は 10 件、心膜炎疑い事例は 33 件が報告されている。一方で、医療関
係者から報告され、医学的に確認されたと考えられる副反応疑い事例※(以下、
「medically confirmed AE」という。)については、心筋炎疑い事例は3件、
心膜炎疑い事例は 12 件であった。
※:medically confirmed AE の定義は以下のとおり。
1. 医師、歯科医師、薬剤師、看護師、検死官、その他各国の規制で定められた医学的資格を有する者に
より報告又は確認された症例。
2. 患者(被接種者)が副反応発現に関して、それを裏付ける医療記録を提供した場合。
3. 患者(被接種者)が複数の副反応を報告した場合、少なくとも 1 つの副反応に対し医学的な確認を受
けた場合。
4. 医学的資格を有する患者、友人、患者の親族又は介護者が報告した場合。
5. 全ての文献報告
1