よむ、つかう、まなぶ。
資料4-2 ワクチンの安全性に関する評価について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
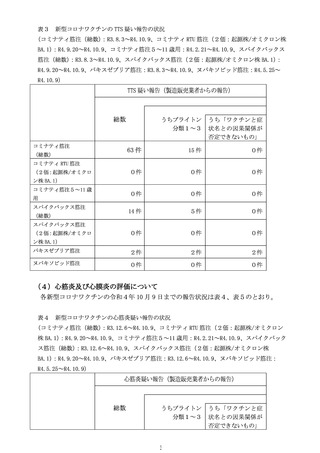
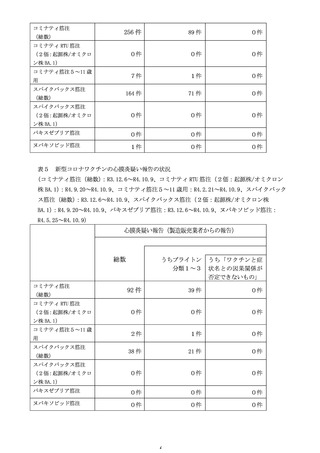
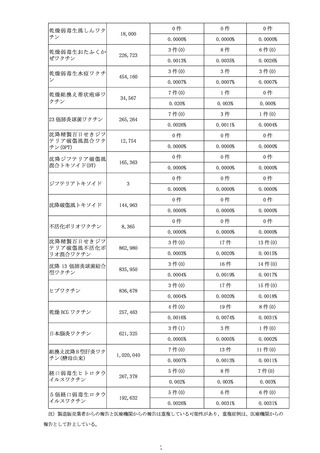
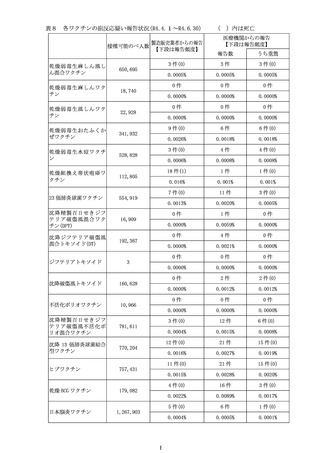
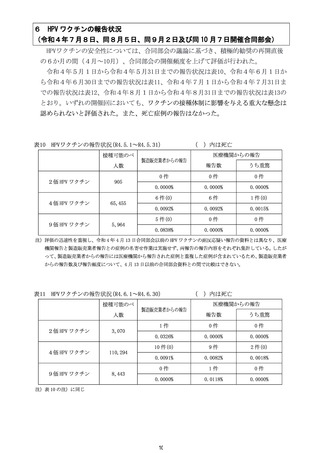
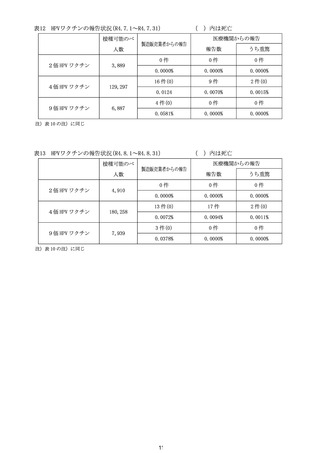
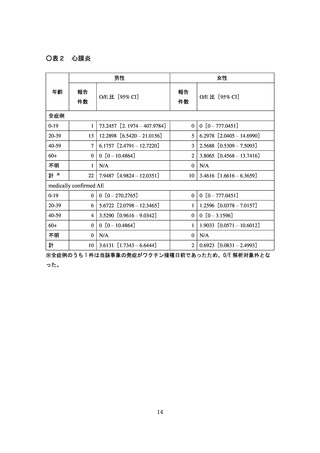
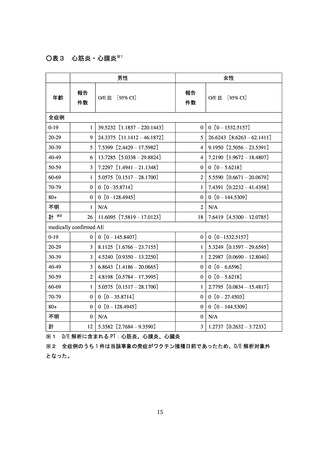
計学的に有意な差が認められたものの、心筋炎では有意な差は認められず、現
時点で両症状において一貫した結果は得られていない(別添2)。
4.海外添付文書の記載状況等
(1)添付文書の記載状況
オーストラリアにおいては、2022 年6月 22 日に添付文書が改訂され、
「4.8
ADVERSE EFFECTS (UNDESIRABLE EFFECTS)」の「Adverse reactions from postmarketing experience」として、心膜炎が位置付けられている(別添3)。
英国、EU 又はカナダにおいては、現時点で、本剤接種後の心筋炎等につい
て、添付文書において注意喚起はなされていない。なお、米国においては、現
時点で承認されていない。
(2)その他の関連文書の記載状況
本剤と心筋炎等の因果関係については、海外(英国、EU、オーストラリア、
カナダ)の RMP(医薬品リスク管理計画書)においては、現時点では「重要な潜
在的なリスク(Important potential risks)」とされている。
EU においては、本年 6 月 17 日の「COVID-19 vaccines safety update」にお
いて、「心筋炎等が本剤の副反応なのか検討するため、PRAC(Pharmacovigilance
Risk Assessment Committee)において評価を開始した」とされている5が、評
価結果については、現時点において公開されていない。
米国 FDA においては、本剤の EUA 承認検討のために本年6月7日に開催さ
れた「Vaccines and Related Biological Products Advisory Committee」にお
いて、心筋炎等について、本剤の「重要な特定されたリスク( Important
identified risks)」として位置付けることを推奨する、と報告しているが6、
具体的な注意喚起の内容については、今後、FDA と製造販売業者にて調整する
こととされている。
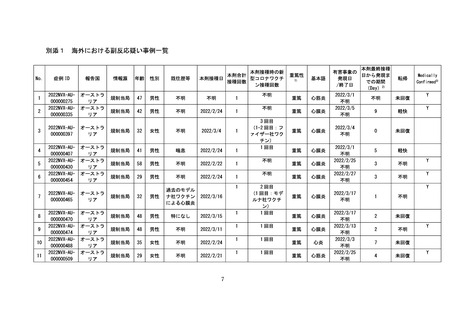
5.添付文書の改訂案について(別紙1)
3.及び4.を総合的に勘案し、現時点において得られている知見は限られ
ているが、更なる副反応疑い事例の集積やそれを踏まえた安全対策措置の検討
5
https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-
vaccines-safety-update-17-june-2022_en.pdf
6
https://www.fda.gov/media/159004/download
4
時点で両症状において一貫した結果は得られていない(別添2)。
4.海外添付文書の記載状況等
(1)添付文書の記載状況
オーストラリアにおいては、2022 年6月 22 日に添付文書が改訂され、
「4.8
ADVERSE EFFECTS (UNDESIRABLE EFFECTS)」の「Adverse reactions from postmarketing experience」として、心膜炎が位置付けられている(別添3)。
英国、EU 又はカナダにおいては、現時点で、本剤接種後の心筋炎等につい
て、添付文書において注意喚起はなされていない。なお、米国においては、現
時点で承認されていない。
(2)その他の関連文書の記載状況
本剤と心筋炎等の因果関係については、海外(英国、EU、オーストラリア、
カナダ)の RMP(医薬品リスク管理計画書)においては、現時点では「重要な潜
在的なリスク(Important potential risks)」とされている。
EU においては、本年 6 月 17 日の「COVID-19 vaccines safety update」にお
いて、「心筋炎等が本剤の副反応なのか検討するため、PRAC(Pharmacovigilance
Risk Assessment Committee)において評価を開始した」とされている5が、評
価結果については、現時点において公開されていない。
米国 FDA においては、本剤の EUA 承認検討のために本年6月7日に開催さ
れた「Vaccines and Related Biological Products Advisory Committee」にお
いて、心筋炎等について、本剤の「重要な特定されたリスク( Important
identified risks)」として位置付けることを推奨する、と報告しているが6、
具体的な注意喚起の内容については、今後、FDA と製造販売業者にて調整する
こととされている。
5.添付文書の改訂案について(別紙1)
3.及び4.を総合的に勘案し、現時点において得られている知見は限られ
ているが、更なる副反応疑い事例の集積やそれを踏まえた安全対策措置の検討
5
https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-
vaccines-safety-update-17-june-2022_en.pdf
6
https://www.fda.gov/media/159004/download
4