よむ、つかう、まなぶ。
資料4-2 ワクチンの安全性に関する評価について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
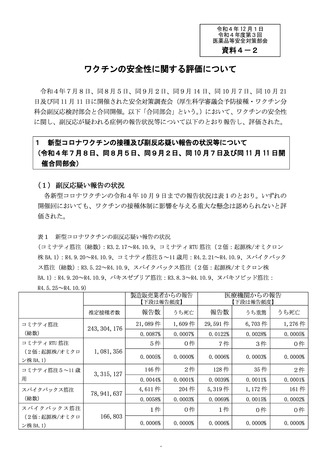
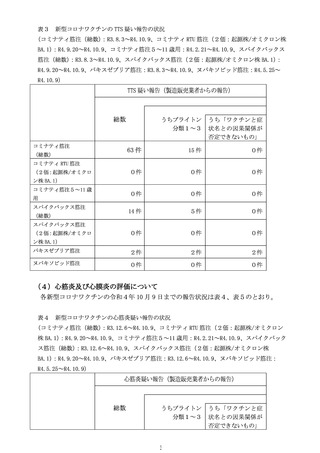
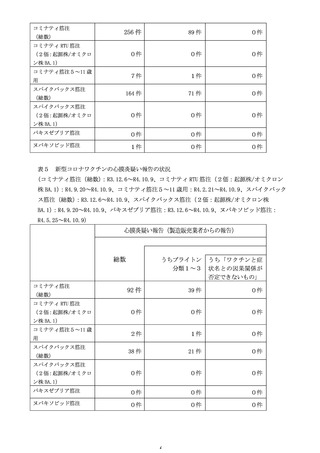
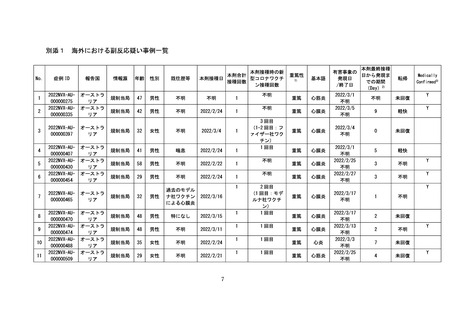
3 新型コロナワクチンの副反応への対応について
(令和4年9月 14 日、同 10 月 21 日及び令和4年 11 月 11 日開催合同部会)
令和4年9月14日に開催された合同部会においては、新規に接種が開始されるコミナテ
ィRTU筋注(2価:起源株/オミクロン株BA.1)およびスパイクバックス筋注(2価:起源株
/オミクロン株BA.1)の副反応疑い報告基準について、現時点において臨時接種の対象と
なっている全ての新型コロナワクチンと同様に、アナフィラキシー、血小板減少を伴う血
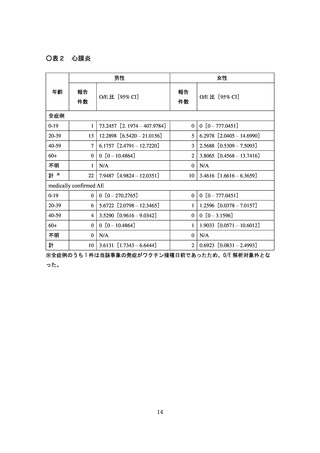
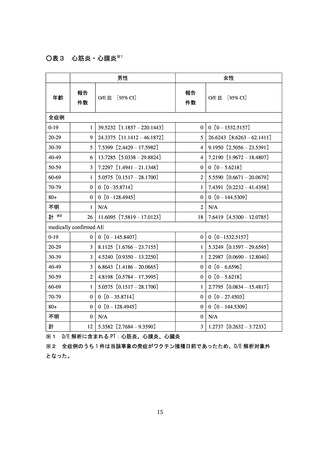
栓症(TTS)、心筋炎、心膜炎、その他の反応を副反応疑い報告基準として扱うことが副反
応検討部会委員によって議決された。
令和4年10月21日に開催された合同部会においては、新規に接種が開始されるコミナテ
ィRTU筋注(2価:起源株/オミクロン株BA.4-5)の副反応疑い報告基準について、現時点
において臨時接種の対象となっている全ての新型コロナワクチンと同様に、アナフィラキ
シー、血小板減少を伴う血栓症(TTS)、心筋炎、心膜炎、その他の反応を副反応疑い報告
基準として扱うことが副反応検討部会委員によって議決された。また、コミナティ筋注6ヵ
月~4歳用の接種開始に当たり、接種後に発生した熱性けいれんについてより広く情報す
るべきとの議論を踏まえ、全ての新型コロナワクチンの副反応疑い報告基準について、熱
性けいれんを追加することが副反応検討部会委員によって議決された(別添3参考)。
令和4年11月11日に開催された合同部会においては、新規に接種が開始されるスパイク
バックス筋注(2価:起源株/オミクロン株BA.4-5)の副反応疑い報告基準について、現時
点において臨時接種の対象となっている全ての新型コロナワクチンと同様に、アナフィラ
キシー、血小板減少を伴う血栓症(TTS)、心筋炎、心膜炎、熱性けいれん、その他の反応
を副反応疑い報告基準として扱うことが副反応検討部会委員によって議決された。
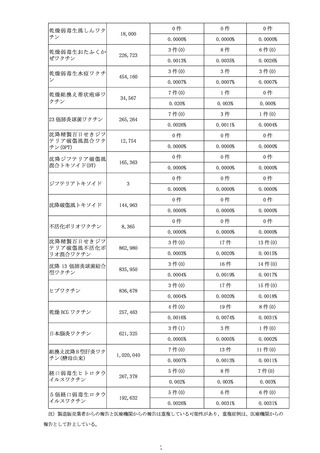
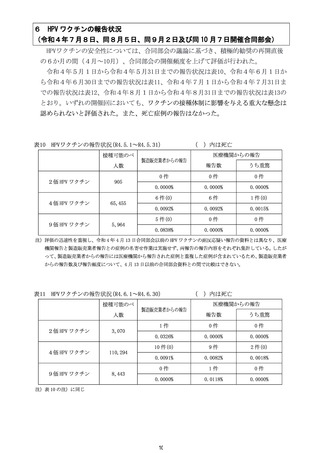
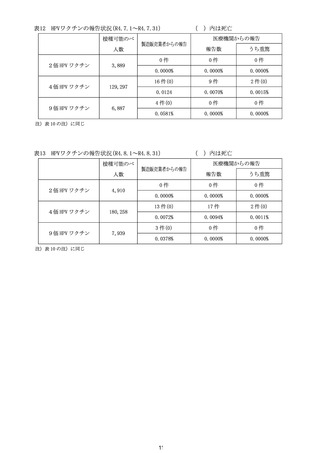
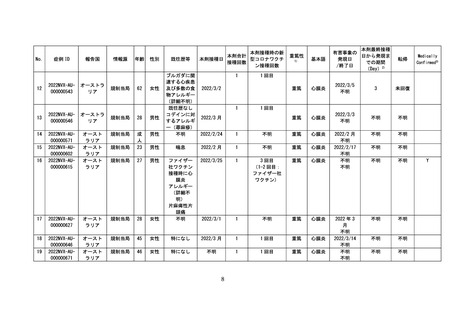
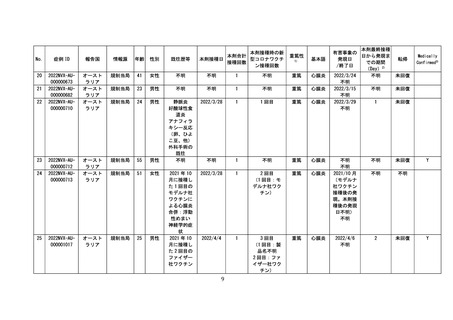
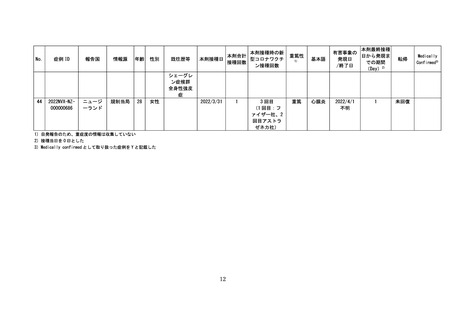
4 各ワクチンの報告状況(令和4年7月8日及び同 10 月 7 日開催合同部会)
(1) 麻しん、風しん、おたふくかぜ、水痘、帯状疱疹、23 価肺炎球菌、百日せき、
ジフテリア、破傷風、不活化ポリオ、肺炎球菌(13 価)
、ヒブ、BCG、日本脳
炎、B 型肝炎、ロタウイルス各ワクチンの報告状況
令和4年1月1日から令和4年3月 31 日までの報告状況は表7、令和4年4月1
日から令和4年6月 30 日までの報告状況は表8のとおり。いずれの開催回において
も、これまでに報告されている各ワクチンの報告状況と比べて大きな変化はなく、新
たな措置をとる必要はないとされた。
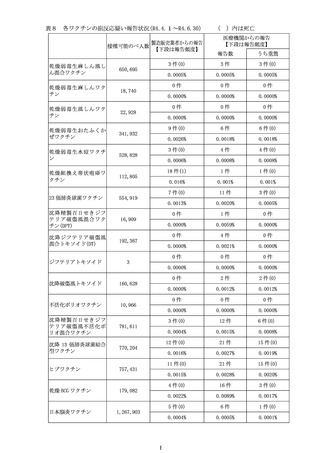
表7 各ワクチンの副反応疑い報告状況(R4.1.1~R4.3.31)
製造販売業者からの報告
接種可能のべ人数
【下段は報告頻度】
乾燥弱毒生麻しん風し
ん混合ワクチン
464,017
乾燥弱毒生麻しんワク
チン
9,734
6
( )内は死亡
医療機関からの報告
【下段は報告頻度】
報告数
うち重篤
0件
6件
4 件(0)
0.0000%
0.0013%
0.0009%
0件
0件
0件
0.0000%
0.0000%
0.0000%
(令和4年9月 14 日、同 10 月 21 日及び令和4年 11 月 11 日開催合同部会)
令和4年9月14日に開催された合同部会においては、新規に接種が開始されるコミナテ
ィRTU筋注(2価:起源株/オミクロン株BA.1)およびスパイクバックス筋注(2価:起源株
/オミクロン株BA.1)の副反応疑い報告基準について、現時点において臨時接種の対象と
なっている全ての新型コロナワクチンと同様に、アナフィラキシー、血小板減少を伴う血
栓症(TTS)、心筋炎、心膜炎、その他の反応を副反応疑い報告基準として扱うことが副反
応検討部会委員によって議決された。
令和4年10月21日に開催された合同部会においては、新規に接種が開始されるコミナテ
ィRTU筋注(2価:起源株/オミクロン株BA.4-5)の副反応疑い報告基準について、現時点
において臨時接種の対象となっている全ての新型コロナワクチンと同様に、アナフィラキ
シー、血小板減少を伴う血栓症(TTS)、心筋炎、心膜炎、その他の反応を副反応疑い報告
基準として扱うことが副反応検討部会委員によって議決された。また、コミナティ筋注6ヵ
月~4歳用の接種開始に当たり、接種後に発生した熱性けいれんについてより広く情報す
るべきとの議論を踏まえ、全ての新型コロナワクチンの副反応疑い報告基準について、熱
性けいれんを追加することが副反応検討部会委員によって議決された(別添3参考)。
令和4年11月11日に開催された合同部会においては、新規に接種が開始されるスパイク
バックス筋注(2価:起源株/オミクロン株BA.4-5)の副反応疑い報告基準について、現時
点において臨時接種の対象となっている全ての新型コロナワクチンと同様に、アナフィラ
キシー、血小板減少を伴う血栓症(TTS)、心筋炎、心膜炎、熱性けいれん、その他の反応
を副反応疑い報告基準として扱うことが副反応検討部会委員によって議決された。
4 各ワクチンの報告状況(令和4年7月8日及び同 10 月 7 日開催合同部会)
(1) 麻しん、風しん、おたふくかぜ、水痘、帯状疱疹、23 価肺炎球菌、百日せき、
ジフテリア、破傷風、不活化ポリオ、肺炎球菌(13 価)
、ヒブ、BCG、日本脳
炎、B 型肝炎、ロタウイルス各ワクチンの報告状況
令和4年1月1日から令和4年3月 31 日までの報告状況は表7、令和4年4月1
日から令和4年6月 30 日までの報告状況は表8のとおり。いずれの開催回において
も、これまでに報告されている各ワクチンの報告状況と比べて大きな変化はなく、新
たな措置をとる必要はないとされた。
表7 各ワクチンの副反応疑い報告状況(R4.1.1~R4.3.31)
製造販売業者からの報告
接種可能のべ人数
【下段は報告頻度】
乾燥弱毒生麻しん風し
ん混合ワクチン
464,017
乾燥弱毒生麻しんワク
チン
9,734
6
( )内は死亡
医療機関からの報告
【下段は報告頻度】
報告数
うち重篤
0件
6件
4 件(0)
0.0000%
0.0013%
0.0009%
0件
0件
0件
0.0000%
0.0000%
0.0000%