よむ、つかう、まなぶ。
資料2-2 精製ヒアルロン酸ナトリウムのリスク評価について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
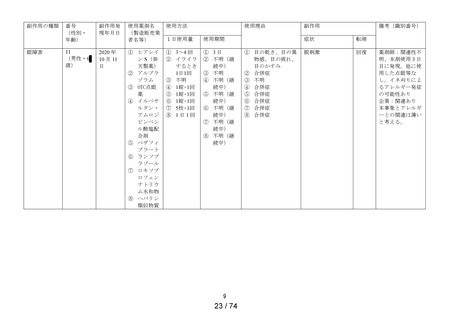
令和5年7月 25 日
令和5年度第4回医薬品等安全対策部会安全対策調査会
資料2-2
精製ヒアルロン酸ナトリウムのリスク評価について
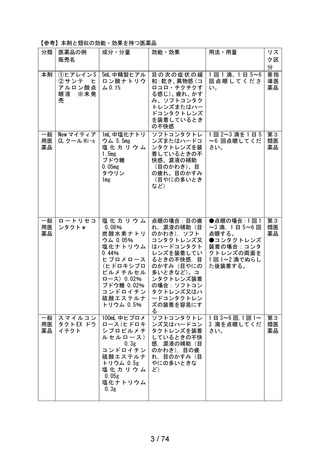
成分・含量
5mL 中精製ヒアルロン酸ナトリウム 0.1%
薬効分類
一般点眼薬
投与経路
外用
販売名(製造販売業 ① ヒアレイン S
者)
② サンテ ヒアルロン酸点眼液
(参天製薬株式会社)
※未発売
効能・効果
目の次の症状の緩和:乾き、異物感(コロコロ・チクチクす
る感じ)、疲れ、かすみ、ソフトコンタクトレンズまたはハー
ドコンタクトレンズを装着しているときの不快感
用法・用量
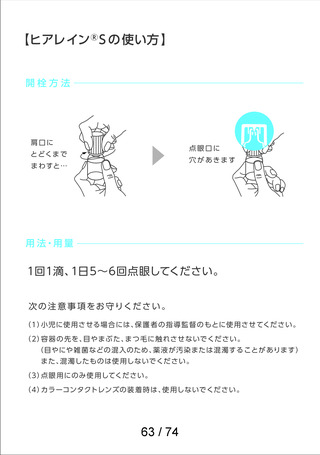
1 回 1 滴、1 日 5~6 回点眼してください。
承認年月日
2020 年5月8日
製造販売開始日
2020 年9月 16 日
評価を行う理由
2023 年9月 15 日の製造販売後調査終了見込みに伴い、一般
用医薬品としての販売の可否について判断を行うため
製造販売後調査概要 調査期間:2020 年9月 16 日~2022 年9月 15 日
(第一・二次報告書) 特別調査:1,288 症例
副作用:21 例 32 件(1.63%)
うち重篤な副作用:なし
未知の副作用:流涙増加及び霧視各2件、頭部不快感、
眼精疲労、眼部不快感、眼瞼皮膚乾燥、
眼内異物及び医療機器色調の問題各1
件
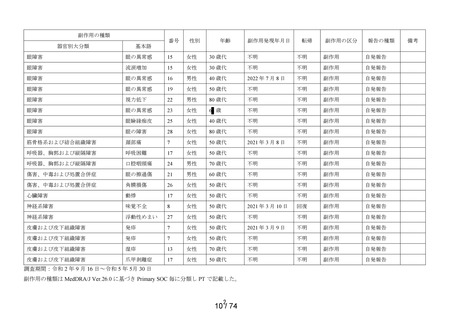
一般調査
副作用:35 例 49 件
うち重篤な副作用:なし
未知の副作用:目の異常感8件、霧視及び発疹各2件、
麦粒腫、帯状疱疹、味覚不全、眼部不快
感、眼精疲労、結膜出血、調節障害、複
視、頸部痛、口の感覚麻痺、体調不良、
状態悪化、流涙増加、呼吸困難、動悸、
湿疹及び爪甲剥離症各1件
製造販売後調査概要
(追加調査報告書)
調査期間:2023 年3月1日~2023 年5月 30 日
特別調査:363 症例
副作用:1例1件(0.28%)
うち重篤な副作用:なし
未知の副作用:なし
1 / 74
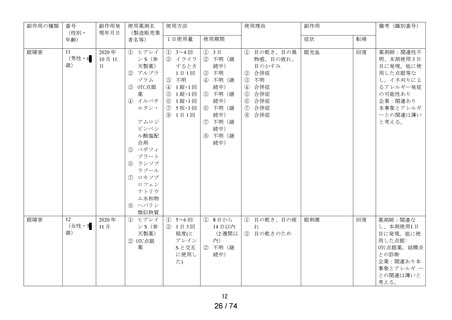
令和5年度第4回医薬品等安全対策部会安全対策調査会
資料2-2
精製ヒアルロン酸ナトリウムのリスク評価について
成分・含量
5mL 中精製ヒアルロン酸ナトリウム 0.1%
薬効分類
一般点眼薬
投与経路
外用
販売名(製造販売業 ① ヒアレイン S
者)
② サンテ ヒアルロン酸点眼液
(参天製薬株式会社)
※未発売
効能・効果
目の次の症状の緩和:乾き、異物感(コロコロ・チクチクす
る感じ)、疲れ、かすみ、ソフトコンタクトレンズまたはハー
ドコンタクトレンズを装着しているときの不快感
用法・用量
1 回 1 滴、1 日 5~6 回点眼してください。
承認年月日
2020 年5月8日
製造販売開始日
2020 年9月 16 日
評価を行う理由
2023 年9月 15 日の製造販売後調査終了見込みに伴い、一般
用医薬品としての販売の可否について判断を行うため
製造販売後調査概要 調査期間:2020 年9月 16 日~2022 年9月 15 日
(第一・二次報告書) 特別調査:1,288 症例
副作用:21 例 32 件(1.63%)
うち重篤な副作用:なし
未知の副作用:流涙増加及び霧視各2件、頭部不快感、
眼精疲労、眼部不快感、眼瞼皮膚乾燥、
眼内異物及び医療機器色調の問題各1
件
一般調査
副作用:35 例 49 件
うち重篤な副作用:なし
未知の副作用:目の異常感8件、霧視及び発疹各2件、
麦粒腫、帯状疱疹、味覚不全、眼部不快
感、眼精疲労、結膜出血、調節障害、複
視、頸部痛、口の感覚麻痺、体調不良、
状態悪化、流涙増加、呼吸困難、動悸、
湿疹及び爪甲剥離症各1件
製造販売後調査概要
(追加調査報告書)
調査期間:2023 年3月1日~2023 年5月 30 日
特別調査:363 症例
副作用:1例1件(0.28%)
うち重篤な副作用:なし
未知の副作用:なし
1 / 74