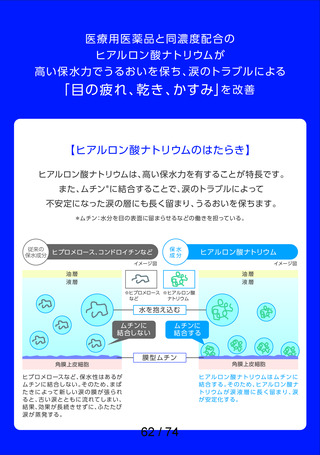
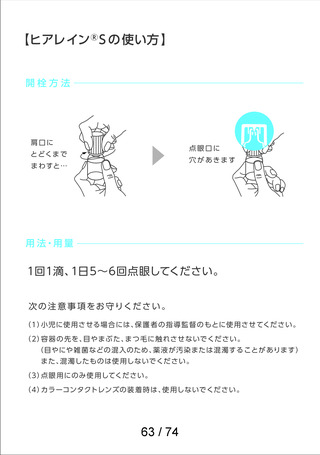
よむ、つかう、まなぶ。
資料2-2 精製ヒアルロン酸ナトリウムのリスク評価について (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
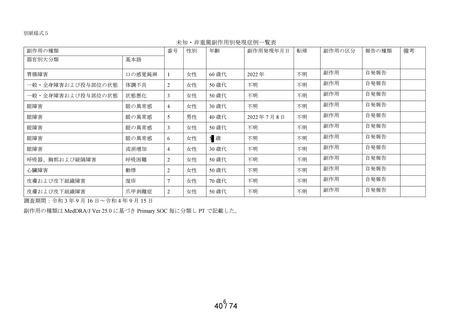
別紙様式3
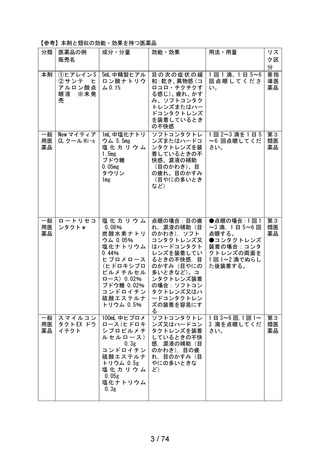
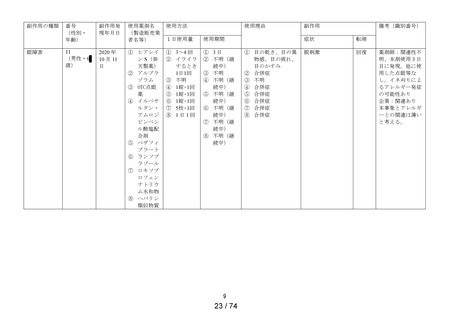
副作用種類別発現状況
① 調査施設数
② 調査症例数
③ 副作用発現症例数
④ 副作用発現件数
⑤副作用発現症例率
(③÷②×100)
出荷数量
副作用の種類
[感染症および寄生虫症]
結膜炎
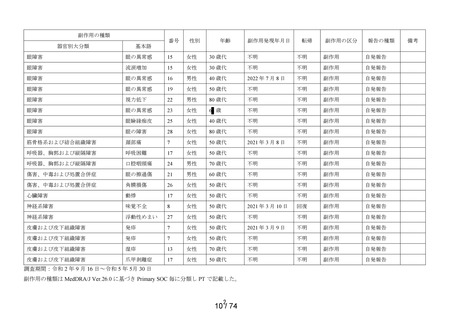
[神経系障害]
頭部不快感※
[眼障害]
眼の異常感※
眼精疲労※
眼瞼炎
結膜浮腫※
角膜びらん
眼瞼紅斑
眼脂
眼刺激
眼痛
角膜炎
眼部腫脹
流涙増加※
眼充血
点状角膜炎
眼瞼腫脹※
霧視※
眼の異物感
結膜充血
眼瞼そう痒症
眼そう痒症
眼部不快感※
眼瞼皮膚乾燥※
[胃腸障害]
嘔吐※
[皮膚および皮下組織障害]
発疹※
[傷害、中毒および処置合併症]
眼内異物※
[製品の問題]
医療機器色調の問題※
承認時までの調査※1
629
4,125
71
84
1.72%
定期(第1次)
454
1,288
21
32
1.63%
販売開始以降の累計
454
1,288
21
32
1.63%
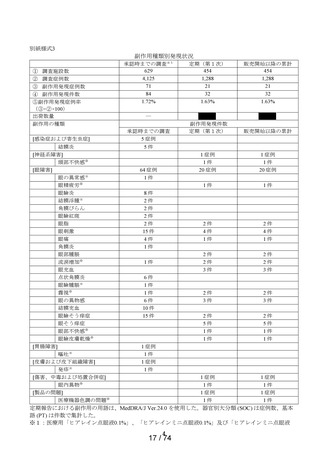
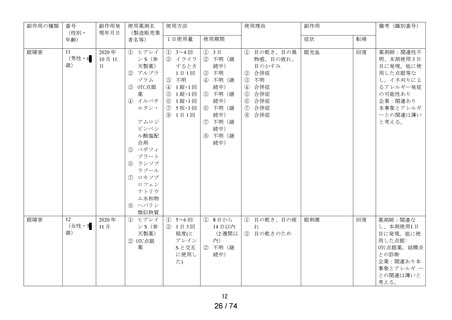
副作用発現件数
定期(第1次)
販売開始以降の累計
1 症例
1件
20 症例
1 症例
1件
20 症例
1件
1件
2件
4件
1件
2件
4件
1件
1件
2件
2件
3件
2件
2件
3件
6件
1件
1件
6件
10 件
15 件
2件
3件
2件
3件
2件
5件
1件
1件
2件
5件
1件
1件
1 症例
1件
1 症例
1件
1 症例
1件
1 症例
1件
―
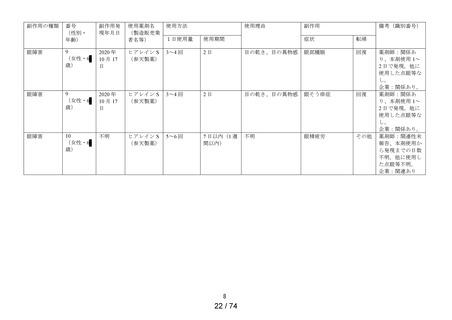
承認時までの調査
5 症例
5件
64 症例
1件
8件
2件
2件
2件
2件
15 件
4件
1件
1 症例
1件
1 症例
1件
定期報告における副作用の用語は、MedDRA/J Ver.24.0 を使用した。器官別大分類 (SOC) は症例数、基本
語 (PT) は件数で集計した。
※1:医療用「ヒアレイン点眼液0.1%」、「ヒアレインミニ点眼液0.1%」及び「ヒアレインミニ点眼液
4
17 / 74
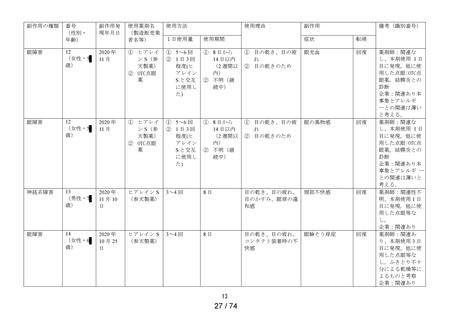
副作用種類別発現状況
① 調査施設数
② 調査症例数
③ 副作用発現症例数
④ 副作用発現件数
⑤副作用発現症例率
(③÷②×100)
出荷数量
副作用の種類
[感染症および寄生虫症]
結膜炎
[神経系障害]
頭部不快感※
[眼障害]
眼の異常感※
眼精疲労※
眼瞼炎
結膜浮腫※
角膜びらん
眼瞼紅斑
眼脂
眼刺激
眼痛
角膜炎
眼部腫脹
流涙増加※
眼充血
点状角膜炎
眼瞼腫脹※
霧視※
眼の異物感
結膜充血
眼瞼そう痒症
眼そう痒症
眼部不快感※
眼瞼皮膚乾燥※
[胃腸障害]
嘔吐※
[皮膚および皮下組織障害]
発疹※
[傷害、中毒および処置合併症]
眼内異物※
[製品の問題]
医療機器色調の問題※
承認時までの調査※1
629
4,125
71
84
1.72%
定期(第1次)
454
1,288
21
32
1.63%
販売開始以降の累計
454
1,288
21
32
1.63%
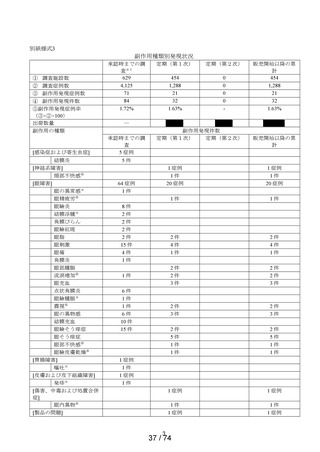
副作用発現件数
定期(第1次)
販売開始以降の累計
1 症例
1件
20 症例
1 症例
1件
20 症例
1件
1件
2件
4件
1件
2件
4件
1件
1件
2件
2件
3件
2件
2件
3件
6件
1件
1件
6件
10 件
15 件
2件
3件
2件
3件
2件
5件
1件
1件
2件
5件
1件
1件
1 症例
1件
1 症例
1件
1 症例
1件
1 症例
1件
―
承認時までの調査
5 症例
5件
64 症例
1件
8件
2件
2件
2件
2件
15 件
4件
1件
1 症例
1件
1 症例
1件
定期報告における副作用の用語は、MedDRA/J Ver.24.0 を使用した。器官別大分類 (SOC) は症例数、基本
語 (PT) は件数で集計した。
※1:医療用「ヒアレイン点眼液0.1%」、「ヒアレインミニ点眼液0.1%」及び「ヒアレインミニ点眼液
4
17 / 74