よむ、つかう、まなぶ。
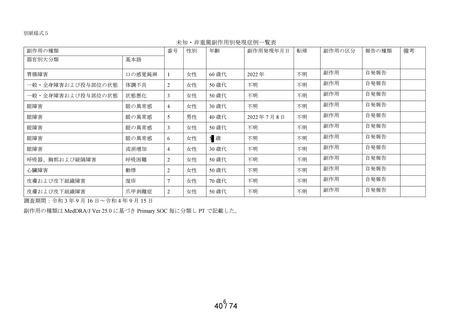
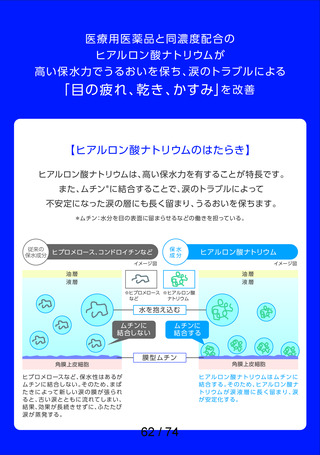
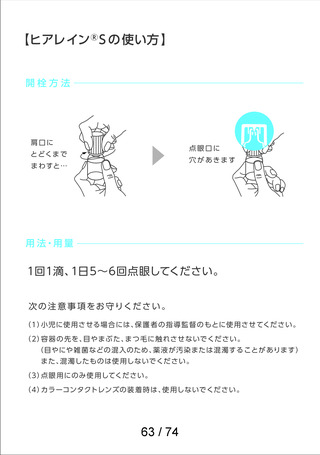
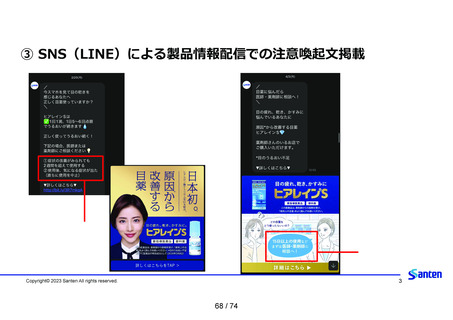
資料2-2 精製ヒアルロン酸ナトリウムのリスク評価について (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34324.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 医薬品等安全対策部会 安全対策調査会(令和5年度第4回 7/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙(2)
調査結果に対する見解と今後の安全対策
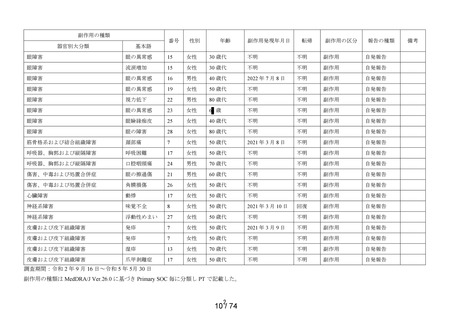
副作用頻度調査において、前回調査期間(令和 2 年 9 月 16 日~令和 3 年 9 月 15 日)に調査が
完了していたため、当該調査期間(令和 3 年 9 月 16 日~令和 4 年 9 月 15 日)に収集された副作
用はなかった。前回調査期間に収集した副作用発現例数は1,288例中 21例(副作用発現症例率
1.63%)32 件であり、承認時までの調査と比較して特に副作用発現症例率が高い傾向はみられ
ず、報告された副作用についても特段の変化は認められなかった。また、収集された副作用はす
べて非重篤であり、未知の副作用は9例10件であった。
一般調査において、当該調査期間に収集した副作用発現例数は 14 例 20 件で、収集された副作
用はすべて非重篤であり、未知の副作用は7例12件であった。
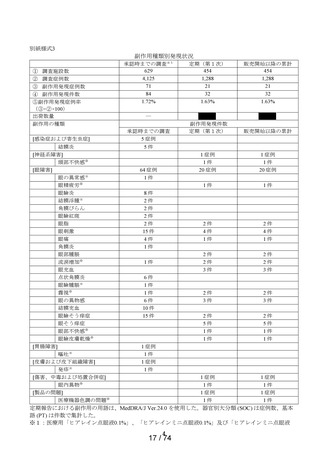
上述の通り、当該調査期間に収集した重篤な副作用はなく、「眼の異常感」が4件、「呼吸困
難」、「口の感覚鈍麻」、「湿疹」、「状態悪化」、「体調不良」、「爪甲剥離症」、「動悸」
及び「流涙増加」が各1 件であり、眼障害は本剤の使用目的となる眼疾患の状態に起因すると考
えられた。眼障害以外の副作用は患者背景に関連する合併症を有する患者からの報告が多く、ま
た1件ずつの報告であるため、本剤との関連性は低いと考える。
適正使用状況について、「してはいけないこと」に該当する症例は、ドライアイ患者の使
用報告が7件あり、いずれも副作用は確認されなかった。またスティ-ブンス・ジョンソン症
候群の患者の使用報告が1件あり、副作用として体調不良、動悸、 呼吸困難、 爪甲剥離症が
報告された。
1日の使用回数については、過少量投与(1日1~2回使用)の報告が4件、過量投与(1日10回
程度)の報告が1件であった。投与日数が15日以上の症例は3件報告され、医師または薬剤師
への相談の有無は、1件はあり、1件はなし、1件は不明であった。いずれの症例においても副
作用は確認されなかった。
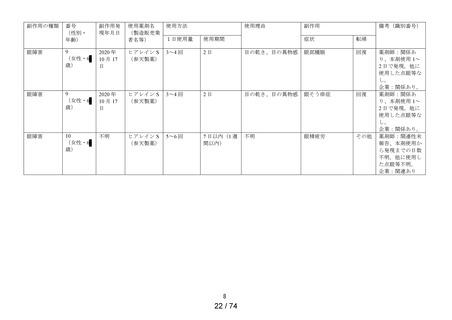
本剤の承認日以降、当該調査期間終了日(令和 4 年 9 月 15 日)までに、本剤及び本剤と同成
分(精製ヒアルロン酸ナトリウム)の医療用医薬品に関連した措置報告や研究報告に該当する情
報の入手はなかった。また、「使用上の注意」の改訂もなかった。
以上の検討より、現時点では本剤の安全性について特段の問題点はなく、現時点では「使用上
の注意」の改訂等の安全確保措置は不要と考える。引き続き、本剤の副作用等の発現状況につい
て十分注意するとともに本製品の適正使用を推進していく所存である。
8
42 / 74
調査結果に対する見解と今後の安全対策
副作用頻度調査において、前回調査期間(令和 2 年 9 月 16 日~令和 3 年 9 月 15 日)に調査が
完了していたため、当該調査期間(令和 3 年 9 月 16 日~令和 4 年 9 月 15 日)に収集された副作
用はなかった。前回調査期間に収集した副作用発現例数は1,288例中 21例(副作用発現症例率
1.63%)32 件であり、承認時までの調査と比較して特に副作用発現症例率が高い傾向はみられ
ず、報告された副作用についても特段の変化は認められなかった。また、収集された副作用はす
べて非重篤であり、未知の副作用は9例10件であった。
一般調査において、当該調査期間に収集した副作用発現例数は 14 例 20 件で、収集された副作
用はすべて非重篤であり、未知の副作用は7例12件であった。
上述の通り、当該調査期間に収集した重篤な副作用はなく、「眼の異常感」が4件、「呼吸困
難」、「口の感覚鈍麻」、「湿疹」、「状態悪化」、「体調不良」、「爪甲剥離症」、「動悸」
及び「流涙増加」が各1 件であり、眼障害は本剤の使用目的となる眼疾患の状態に起因すると考
えられた。眼障害以外の副作用は患者背景に関連する合併症を有する患者からの報告が多く、ま
た1件ずつの報告であるため、本剤との関連性は低いと考える。
適正使用状況について、「してはいけないこと」に該当する症例は、ドライアイ患者の使
用報告が7件あり、いずれも副作用は確認されなかった。またスティ-ブンス・ジョンソン症
候群の患者の使用報告が1件あり、副作用として体調不良、動悸、 呼吸困難、 爪甲剥離症が
報告された。
1日の使用回数については、過少量投与(1日1~2回使用)の報告が4件、過量投与(1日10回
程度)の報告が1件であった。投与日数が15日以上の症例は3件報告され、医師または薬剤師
への相談の有無は、1件はあり、1件はなし、1件は不明であった。いずれの症例においても副
作用は確認されなかった。
本剤の承認日以降、当該調査期間終了日(令和 4 年 9 月 15 日)までに、本剤及び本剤と同成
分(精製ヒアルロン酸ナトリウム)の医療用医薬品に関連した措置報告や研究報告に該当する情
報の入手はなかった。また、「使用上の注意」の改訂もなかった。
以上の検討より、現時点では本剤の安全性について特段の問題点はなく、現時点では「使用上
の注意」の改訂等の安全確保措置は不要と考える。引き続き、本剤の副作用等の発現状況につい
て十分注意するとともに本製品の適正使用を推進していく所存である。
8
42 / 74