よむ、つかう、まなぶ。
資料2-7-2 内閣府健康・医療戦略推進事務局 御提出資料 (19 ページ)
出典
| 公開元URL | https://www8.cao.go.jp/kisei-kaikaku/kisei/meeting/wg/2409_04medical/241125/medical03_agenda.html |
| 出典情報 | 規制改革推進会議 健康・医療・介護ワーキング・グループ(第3回 11/25)《内閣府》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
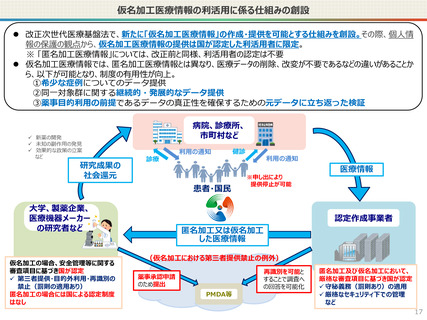
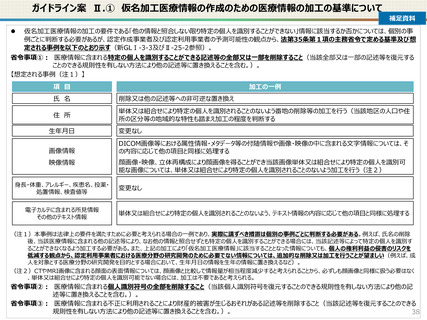
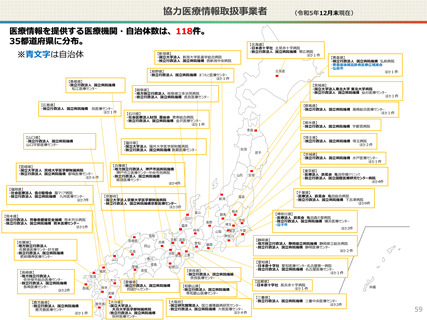
仮名加工医療情報の利活用にあたっての必要なこと(まとめ)
【認定申請】
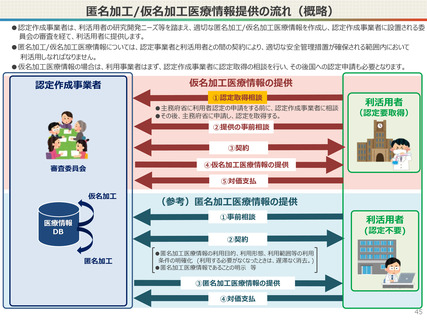
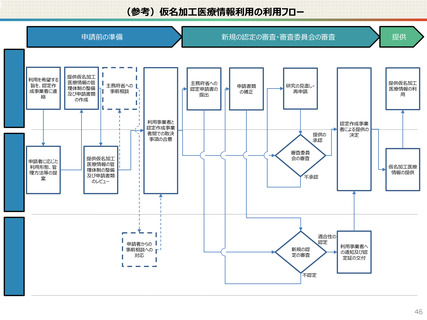
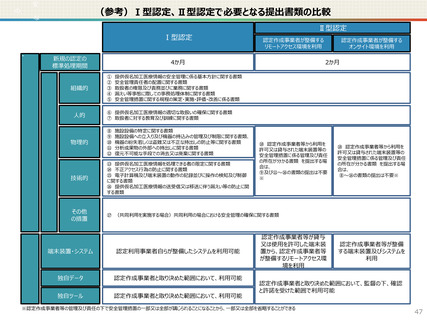
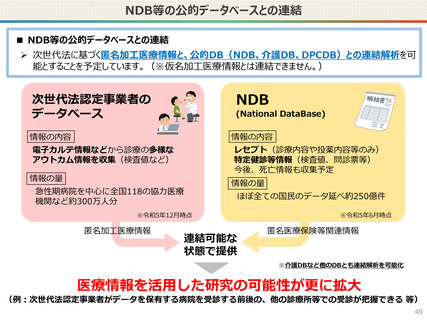
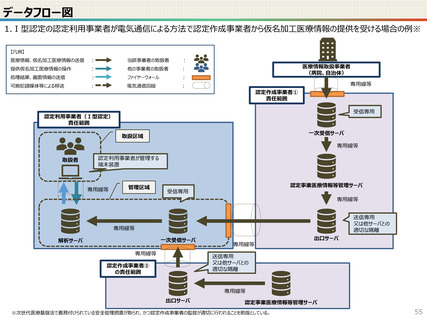
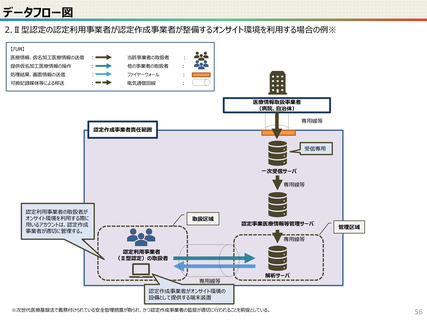
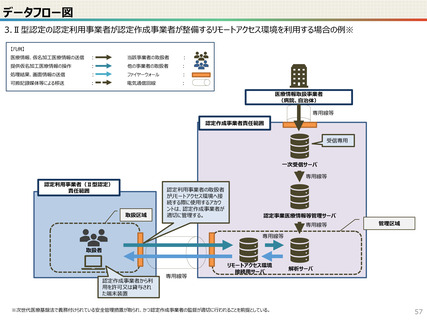
● 仮名加工医療情報の利用にあたっては、国による認定の取得が必要です。
● 認定については、研究者単位ではなく、大学・企業等の「法人」単位での認定申請・取得となります。また、仮名加工
医療情報を共同利用する場合は、共同利用先においても認定取得が必要です。
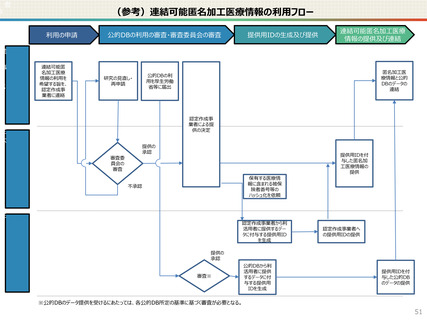
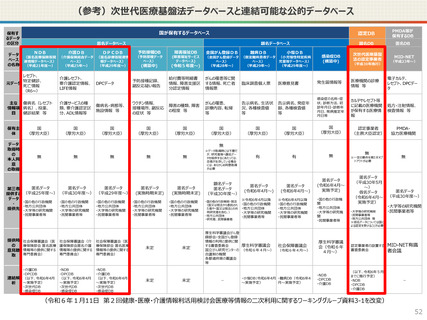
● 国への認定申請にあたっては、あらかじめ作成事業者と、提供方法等(データを受領・保存する、オンサイトセンター
で提供する、ビジティング環境を通じて提供する 等)を取り決めておく必要があります。
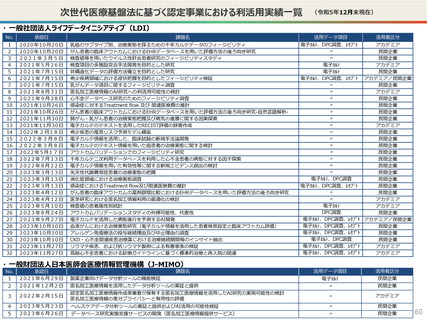
【認定基準】
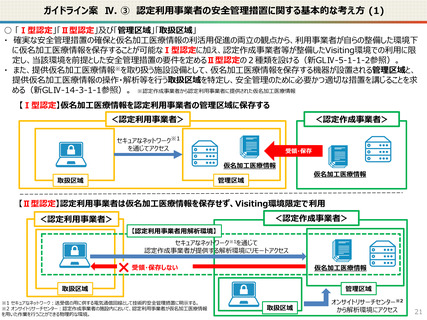
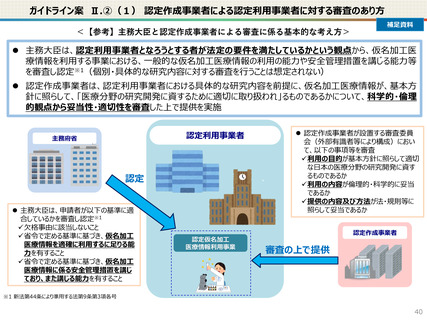
● 国の認定に当たっては、利用能力・安全管理措置などの認定基準を満たしているかを審査することになります。
● なお、利活用者において求められる安全管理措置の内容については、仮名加工医療情報の提供方法(データを
受領・保存する:Ⅰ型、オンサイトセンター、ビジティング環境:Ⅱ型)により異なります。(後述)
【利活用者の義務】
● 仮名加工医療情報の利活用者においては、安全管理措置義務の他、データの利用終了時の消去、再識別の禁
止、第三者提供の禁止(※)等の義務が課されることとなります。(※仮名加工医療情報には該当しない、統計情
報等の研究の成果物を対外公表することを禁止するものではありません。)
● ただし、認定利用事業者による第三者提供の例外として、薬事申請等への活用の観点から、
・厚生労働大臣による医薬品、医療機器等の製造販売の承認等(P)の処分(外国の法令上これに相当する行為
を含む。)を受ける場合であって、
- 厚生労働大臣
- PMDA
- 薬機法に規定する登録認証機関
- 欧州医薬品庁(EMA)
- 英国医薬品医療製品規制庁(MHRA)
- 米国食品医薬品局(FDA)
に提供するとき を規定することを予定しています。
19
【認定申請】
● 仮名加工医療情報の利用にあたっては、国による認定の取得が必要です。
● 認定については、研究者単位ではなく、大学・企業等の「法人」単位での認定申請・取得となります。また、仮名加工
医療情報を共同利用する場合は、共同利用先においても認定取得が必要です。
● 国への認定申請にあたっては、あらかじめ作成事業者と、提供方法等(データを受領・保存する、オンサイトセンター
で提供する、ビジティング環境を通じて提供する 等)を取り決めておく必要があります。
【認定基準】
● 国の認定に当たっては、利用能力・安全管理措置などの認定基準を満たしているかを審査することになります。
● なお、利活用者において求められる安全管理措置の内容については、仮名加工医療情報の提供方法(データを
受領・保存する:Ⅰ型、オンサイトセンター、ビジティング環境:Ⅱ型)により異なります。(後述)
【利活用者の義務】
● 仮名加工医療情報の利活用者においては、安全管理措置義務の他、データの利用終了時の消去、再識別の禁
止、第三者提供の禁止(※)等の義務が課されることとなります。(※仮名加工医療情報には該当しない、統計情
報等の研究の成果物を対外公表することを禁止するものではありません。)
● ただし、認定利用事業者による第三者提供の例外として、薬事申請等への活用の観点から、
・厚生労働大臣による医薬品、医療機器等の製造販売の承認等(P)の処分(外国の法令上これに相当する行為
を含む。)を受ける場合であって、
- 厚生労働大臣
- PMDA
- 薬機法に規定する登録認証機関
- 欧州医薬品庁(EMA)
- 英国医薬品医療製品規制庁(MHRA)
- 米国食品医薬品局(FDA)
に提供するとき を規定することを予定しています。
19