よむ、つかう、まなぶ。
【先進医療合同会議】議題1 別紙1先進医療Bに係る新規技術の科学的評価等について (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_50847.html |
| 出典情報 | 先進医療合同会議(第140回先進医療会議、第171回先進医療技術審査部会 2/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
先進医療審査の事前照会事項に対する回答2
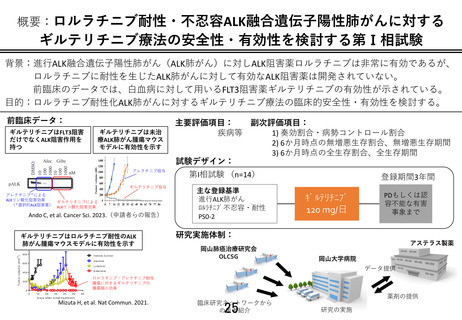
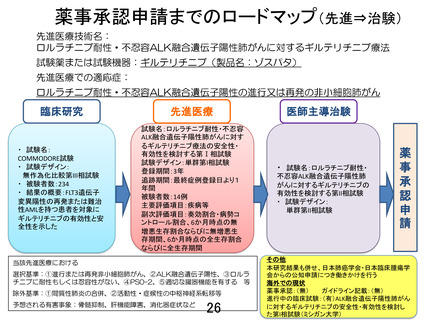
先進医療技術名: ロルラチニブ耐性・不忍容 ALK 融合遺伝子陽性肺がんに対するギルテリチニブ療法
2025 年 1 月 27 日
所属・氏名:岡山大学病院・市原英基
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
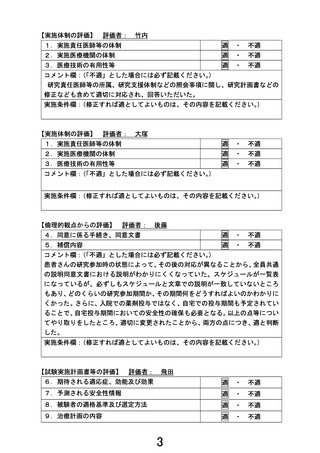
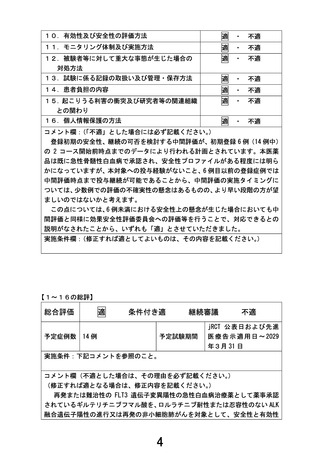
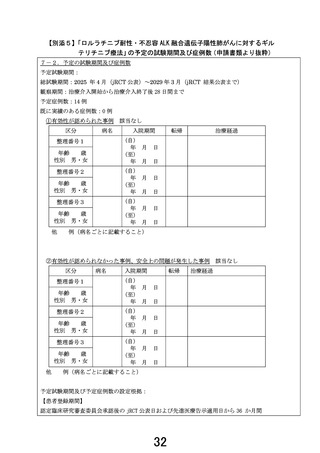
1.先進医療継続の可否の初期評価(中間評価)として 6 例の 2 コース開始直前までの期間が設定さ
れています。
一方で、6 例に至らない時点でも安全性に懸念が生じた際には当該時点で同様の評価を実施すると
も記載されていること、ドラッグ・リポジショニングであっても本対象疾患への投与経験がないための安
全性措置であることから、初期安全性評価の症例数を 6 例未満(例えば 3 例程度)としないのでしょう
か。目標症例数の約半数である 6 例とした理由について説明していただければと考えています。
【回答】
ご指摘ありがとうございます。
新規抗悪性腫瘍薬の第 I あるいは I /II 相臨床試験の汎用的評価デザインとして 3-3 方式があり、
同試験成績に基づき次相・ステップにおける臨床推奨用量を設定する場合、推奨候補の用量水準でさら
に 3 例を追加して計 6 例で安全性を評価したうえで、次相・ステップへと進める方策がとられております。
本剤は既承認効能効果・用法用量の範囲で安全性を担保し市販されています。本研究は効能効果が
承認範囲外ですが、用法用量は再発又は難治性の FLT3 遺伝子変異陽性の急性骨髄性白血病に対し
て承認範囲内であって、本剤単剤による臨床試験であることから、既承認効能効果・用法用量の安全性
情報を参考に初期安全性評価を行うための評価基準を設定し、さらにドラッグ・リポジショニングへの配
慮として評価基準に「薬剤性肺障害」を設け、安全性に配慮することで、上記試験デザインのサイズを考
慮して本研究を計画いたしました。
本研究において先進医療継続可否の初期評価としての中間評価を実施するうえで、効果安全性評価
委員会による評価と研究責任医師の対応を経て先進医療技術審査部会への報告を行うタイミングとし
て、3 例だけの段階では情報量として十分とはいえず、6 例の方が望ましいと考え設定しました。また、「6
例未満」等の曖昧さを含めた時期設定をしますと、研究実施者が成績如何により事後的に調整可能な
計画とも解釈でき、試験結果の恣意性を疑われる可能性が生じますので、避けました。
1
12
先進医療技術名: ロルラチニブ耐性・不忍容 ALK 融合遺伝子陽性肺がんに対するギルテリチニブ療法
2025 年 1 月 27 日
所属・氏名:岡山大学病院・市原英基
※照会に伴い変更が生じた場合は、関係書類も併せて修正して下さい。
1.先進医療継続の可否の初期評価(中間評価)として 6 例の 2 コース開始直前までの期間が設定さ
れています。
一方で、6 例に至らない時点でも安全性に懸念が生じた際には当該時点で同様の評価を実施すると
も記載されていること、ドラッグ・リポジショニングであっても本対象疾患への投与経験がないための安
全性措置であることから、初期安全性評価の症例数を 6 例未満(例えば 3 例程度)としないのでしょう
か。目標症例数の約半数である 6 例とした理由について説明していただければと考えています。
【回答】
ご指摘ありがとうございます。
新規抗悪性腫瘍薬の第 I あるいは I /II 相臨床試験の汎用的評価デザインとして 3-3 方式があり、
同試験成績に基づき次相・ステップにおける臨床推奨用量を設定する場合、推奨候補の用量水準でさら
に 3 例を追加して計 6 例で安全性を評価したうえで、次相・ステップへと進める方策がとられております。
本剤は既承認効能効果・用法用量の範囲で安全性を担保し市販されています。本研究は効能効果が
承認範囲外ですが、用法用量は再発又は難治性の FLT3 遺伝子変異陽性の急性骨髄性白血病に対し
て承認範囲内であって、本剤単剤による臨床試験であることから、既承認効能効果・用法用量の安全性
情報を参考に初期安全性評価を行うための評価基準を設定し、さらにドラッグ・リポジショニングへの配
慮として評価基準に「薬剤性肺障害」を設け、安全性に配慮することで、上記試験デザインのサイズを考
慮して本研究を計画いたしました。
本研究において先進医療継続可否の初期評価としての中間評価を実施するうえで、効果安全性評価
委員会による評価と研究責任医師の対応を経て先進医療技術審査部会への報告を行うタイミングとし
て、3 例だけの段階では情報量として十分とはいえず、6 例の方が望ましいと考え設定しました。また、「6
例未満」等の曖昧さを含めた時期設定をしますと、研究実施者が成績如何により事後的に調整可能な
計画とも解釈でき、試験結果の恣意性を疑われる可能性が生じますので、避けました。
1
12