よむ、つかう、まなぶ。
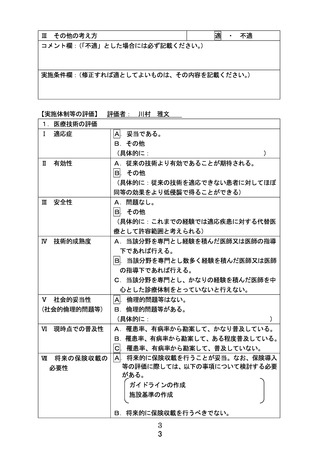
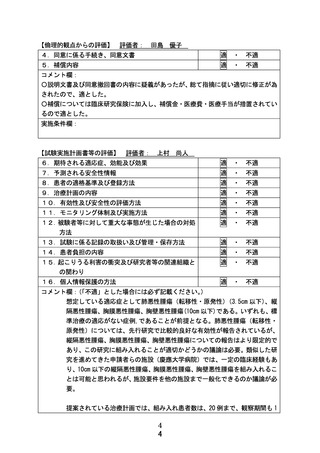
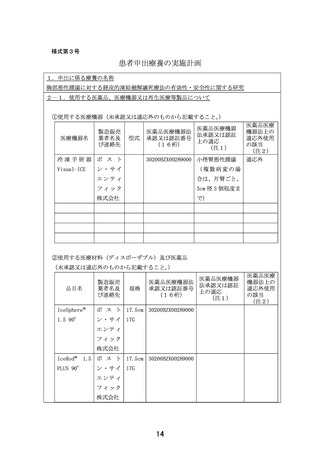
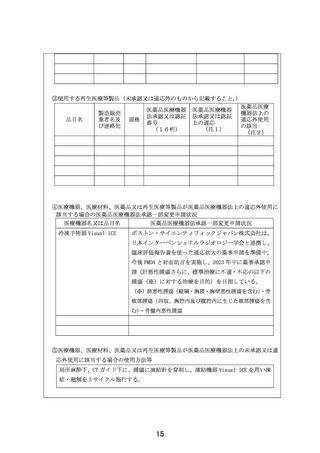
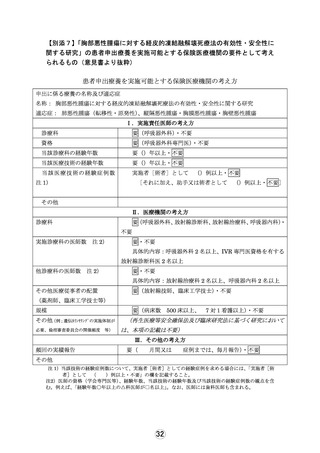
別紙1○1 患者申出療養に係る新規技術の科学的評価等について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000203222_00023.html |
| 出典情報 | 患者申出療養評価会議(第38回 3/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
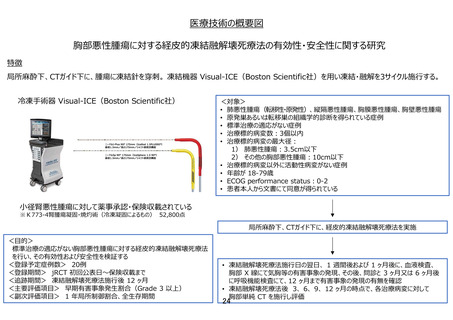
保険収載までのロードマップ
試験機器:Visual-ICE(ボストン・サイエンティフィックジャパン株式会社)
患者申出療養での適応疾患:胸部悪性腫瘍
患者申出療養
・ 試験名:胸部悪性腫瘍に対する経皮的凍結融解壊死療法の有効性・安全性に関
する研究
・ 試験デザイン:単群前向き試験
・ 総研究期間:jRCT初回公表日~2026年9月
(解析期間を含む、試験機器が保険収載された時点で被験者登録は終了、新たに
治験等が必要となった場合、実施可能となった段階で本申出療養はとり下げ予定)
・ 被験者数:20例
・ 主要評価項目: 早期有害事象発生割合(Grade 3以上)
・ 副次評価項目: 1年局所制御割合、全生存期間
ボストン・サイエンティフィックジャパン株式会社は、日本インターベンショナルラジオロジー学会と連携し、臨床評価
報告書を使った適応拡大の薬事申請を準備中。今後PMDAと対面助言を実施し、2023年中に薬事承認申請(肝悪
性腫瘍さらに、標準治療に不適・不応の以下の腫瘍(※)に対する治療を目的)を目指している。
(※)肺悪性腫瘍(縦隔・胸膜・胸壁悪性腫瘍を含む)・骨軟部腫瘍(四肢、胸腔内及び腹腔内に生じた軟部腫瘍を含
む)・骨盤内悪性腫瘍
参考情報 :
同一技術の類似製品が医療ニーズの高い医療機器等の早期導入に関する検討会にて早期導
入品目として選定されている。
選択基準:
・胸部悪性腫瘍 、・標準治療の適応がない、・治療標的病変数3個以内、
・治療標的病変の最大径 ① 肺悪性腫瘍:3.5 ㎝以下、②その他の胸部悪性腫瘍:10 ㎝以下
・治療標的病変以外に活動性病変がない、・年齢18歳以上、79歳以下、・ PS: 0-2
・放射線治療医、放射線診断医、呼吸器内科医、呼吸器外科医を含むカンファレンスで適応があ
ると判断した症例 等
除外基準:
・ コントロール不能の凝固異常、出血性疾患を伴う症例、・全身的治療を要する活動性の全身性・
呼吸器・心膜感染症症例、・手技中に臥位を一定時間保持できない症例 等
予想される有害事象:気胸、低酸素血症、肺炎、凍傷、創感染、血腫、膿胸、神経障害、血栓症等
25
施設基準、術者要件検討時の参考
データとして、必要時に活用予定
保
険
収
載
参考データ
臨
床
試P
験M
要D
否A
相
談
要
実
治
施
験
を
等
検
の
討
不要
薬
事
承
認
欧米での現状
薬事承認・認証
:米国(有・無)欧州(有・無)
ガイドライン記載:(有・無)
進行中の臨床試験(有・無)
試験機器:Visual-ICE(ボストン・サイエンティフィックジャパン株式会社)
患者申出療養での適応疾患:胸部悪性腫瘍
患者申出療養
・ 試験名:胸部悪性腫瘍に対する経皮的凍結融解壊死療法の有効性・安全性に関
する研究
・ 試験デザイン:単群前向き試験
・ 総研究期間:jRCT初回公表日~2026年9月
(解析期間を含む、試験機器が保険収載された時点で被験者登録は終了、新たに
治験等が必要となった場合、実施可能となった段階で本申出療養はとり下げ予定)
・ 被験者数:20例
・ 主要評価項目: 早期有害事象発生割合(Grade 3以上)
・ 副次評価項目: 1年局所制御割合、全生存期間
ボストン・サイエンティフィックジャパン株式会社は、日本インターベンショナルラジオロジー学会と連携し、臨床評価
報告書を使った適応拡大の薬事申請を準備中。今後PMDAと対面助言を実施し、2023年中に薬事承認申請(肝悪
性腫瘍さらに、標準治療に不適・不応の以下の腫瘍(※)に対する治療を目的)を目指している。
(※)肺悪性腫瘍(縦隔・胸膜・胸壁悪性腫瘍を含む)・骨軟部腫瘍(四肢、胸腔内及び腹腔内に生じた軟部腫瘍を含
む)・骨盤内悪性腫瘍
参考情報 :
同一技術の類似製品が医療ニーズの高い医療機器等の早期導入に関する検討会にて早期導
入品目として選定されている。
選択基準:
・胸部悪性腫瘍 、・標準治療の適応がない、・治療標的病変数3個以内、
・治療標的病変の最大径 ① 肺悪性腫瘍:3.5 ㎝以下、②その他の胸部悪性腫瘍:10 ㎝以下
・治療標的病変以外に活動性病変がない、・年齢18歳以上、79歳以下、・ PS: 0-2
・放射線治療医、放射線診断医、呼吸器内科医、呼吸器外科医を含むカンファレンスで適応があ
ると判断した症例 等
除外基準:
・ コントロール不能の凝固異常、出血性疾患を伴う症例、・全身的治療を要する活動性の全身性・
呼吸器・心膜感染症症例、・手技中に臥位を一定時間保持できない症例 等
予想される有害事象:気胸、低酸素血症、肺炎、凍傷、創感染、血腫、膿胸、神経障害、血栓症等
25
施設基準、術者要件検討時の参考
データとして、必要時に活用予定
保
険
収
載
参考データ
臨
床
試P
験M
要D
否A
相
談
要
実
治
施
験
を
等
検
の
討
不要
薬
事
承
認
欧米での現状
薬事承認・認証
:米国(有・無)欧州(有・無)
ガイドライン記載:(有・無)
進行中の臨床試験(有・無)