よむ、つかう、まなぶ。
別紙3 (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
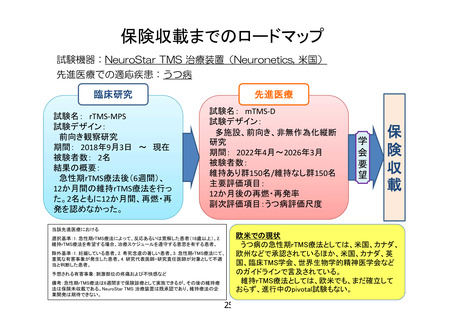
保険収載までのロードマップ
試験機器:NeuroStar TMS 治療装置(Neuronetics, 米国)
先進医療での適応疾患:うつ病
臨床研究
試験名: rTMS-MPS
試験デザイン:
前向き観察研究
期間: 2018年9月3日 ~ 現在
被験者数: 2名
結果の概要:
急性期rTMS療法後(6週間)、
12か月間の維持rTMS療法を行っ
た。2名ともに12か月間、再燃・再
発を認めなかった。
先進医療
試験名: mTMS-D
試験デザイン:
多施設、前向き、非無作為化縦断
研究
期間: 2022年4月~2026年3月
被験者数:
維持あり群150名/維持なし群150名
主要評価項目:
12か月後の再燃・再発率
副次評価項目:うつ病評価尺度
当該先進医療における
選択基準:1. 急性期rTMS療法によって、反応あるいは寛解した患者(18歳以上)。2.
維持rTMS療法を希望する場合、治療スケジュールを遵守する意思を有する患者。
除外基準:1. 妊娠している患者。2. 希死念慮の著しい患者。3. 急性期rTMS療法にて、
重篤な有害事象が発生した患者。4. 研究代表医師・研究責任医師が対象として不適
当と判断した患者。
予想される有害事象:刺激部位の疼痛および不快感など
備考:急性期rTMS療法は6週間まで保険診療として実施できるが、その後の維持療
法は保険未収載である。NeuroStar TMS 治療装置は既承認であり、維持療法の企
業開発は期待できない。
25
学
会
要
望
保
険
収
載
欧米での現状
うつ病の急性期rTMS療法としては、米国、カナダ、
欧州などで承認されているほか、米国、カナダ、英
国、臨床TMS学会、世界生物学的精神医学会など
のガイドラインで言及されている。
維持rTMS療法としては、欧米でも、まだ確立して
おらず、進行中のpivotal試験もない。
試験機器:NeuroStar TMS 治療装置(Neuronetics, 米国)
先進医療での適応疾患:うつ病
臨床研究
試験名: rTMS-MPS
試験デザイン:
前向き観察研究
期間: 2018年9月3日 ~ 現在
被験者数: 2名
結果の概要:
急性期rTMS療法後(6週間)、
12か月間の維持rTMS療法を行っ
た。2名ともに12か月間、再燃・再
発を認めなかった。
先進医療
試験名: mTMS-D
試験デザイン:
多施設、前向き、非無作為化縦断
研究
期間: 2022年4月~2026年3月
被験者数:
維持あり群150名/維持なし群150名
主要評価項目:
12か月後の再燃・再発率
副次評価項目:うつ病評価尺度
当該先進医療における
選択基準:1. 急性期rTMS療法によって、反応あるいは寛解した患者(18歳以上)。2.
維持rTMS療法を希望する場合、治療スケジュールを遵守する意思を有する患者。
除外基準:1. 妊娠している患者。2. 希死念慮の著しい患者。3. 急性期rTMS療法にて、
重篤な有害事象が発生した患者。4. 研究代表医師・研究責任医師が対象として不適
当と判断した患者。
予想される有害事象:刺激部位の疼痛および不快感など
備考:急性期rTMS療法は6週間まで保険診療として実施できるが、その後の維持療
法は保険未収載である。NeuroStar TMS 治療装置は既承認であり、維持療法の企
業開発は期待できない。
25
学
会
要
望
保
険
収
載
欧米での現状
うつ病の急性期rTMS療法としては、米国、カナダ、
欧州などで承認されているほか、米国、カナダ、英
国、臨床TMS学会、世界生物学的精神医学会など
のガイドラインで言及されている。
維持rTMS療法としては、欧米でも、まだ確立して
おらず、進行中のpivotal試験もない。