よむ、つかう、まなぶ。
別紙3 (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
なお、本研究では、薬物療法、精神療法、各種検査などは保険診療として実施する。維
持 rTMS 療法は先進医療として実施する。これらの費用は患者負担である。
研究に用いる医薬品・医療機器、治療法等の情報
NeuroStar TMS 治療装置(Neuronetics, US)医療機器承認番号:22900BZI00029000
rTMS 療法の副作用としては、頭痛、刺激部位の疼痛、刺激部位の不快感、筋収縮の有無
などが 20-40%の頻度で報告されている(鬼頭, 2015)。また、稀に 0.1%未満の頻度でけ
いれん発作が生じることがある(鬼頭, 2015)
。また、rTMS 療法中に、治療を要するような
軽躁・躁病エピソードが発生する頻度は、実刺激群で 0.84%、偽刺激群で 0.74%と報告され
ている(Xia et al., 2008)。
頭痛等、rTMS 療法の刺激に起因する不具合が生じた場合には、刺激部位から前後左右(内
外側)に 0.5cm 程度コイルを移動、もしくはコイル交点を中心に-5~+5 度回転させ、上記
の自覚症状を軽減させる。けいれん発作が生じた場合には、rTMS 療法を中止して経過観察
を行い、けいれん発作が消失することを確認する。軽躁・躁転が生じた場合には、rTMS 療
法を中止し、必要に応じて適切な薬物療法の導入を検討する。
医療機器の概要や副作用についての詳細は添付文書を参照のこと。
試験機器の適用方法
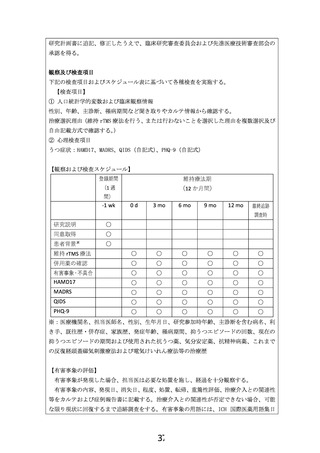
本研究では、維持療法期の前半 6 か月は週 1 日の rTMS 療法を行い、後半 6 か月は隔週 1
日の rTMS 療法を行う。刺激部位、刺激強度、刺激頻度、刺激回数などの刺激条件は、急性
期のものと同一とし、左前頭前野、120% MT、10 Hz、3,000 pulses であり、日本精神神経
学会の rTMS 適正使用指針に準拠する。ほか、規定されていない事項については、必要に応
じて本研究の運営委員会にて決める。なお、研究計画書に追記、修正したうえで、臨床研
究審査委員会および先進医療技術審査部会の承認を得る。
併用薬・併用療法についての規定
薬物療法は、原則として維持療法期間中は同一条件(用量、投与回数、時間など)にて
継続する。用法・用量は、各向精神薬の添付文書に準拠し、単剤投与を推奨する。なお、
規定されていない事項については、必要に応じて本研究の運営委員会にて決める。なお、
36
持 rTMS 療法は先進医療として実施する。これらの費用は患者負担である。
研究に用いる医薬品・医療機器、治療法等の情報
NeuroStar TMS 治療装置(Neuronetics, US)医療機器承認番号:22900BZI00029000
rTMS 療法の副作用としては、頭痛、刺激部位の疼痛、刺激部位の不快感、筋収縮の有無
などが 20-40%の頻度で報告されている(鬼頭, 2015)。また、稀に 0.1%未満の頻度でけ
いれん発作が生じることがある(鬼頭, 2015)
。また、rTMS 療法中に、治療を要するような
軽躁・躁病エピソードが発生する頻度は、実刺激群で 0.84%、偽刺激群で 0.74%と報告され
ている(Xia et al., 2008)。
頭痛等、rTMS 療法の刺激に起因する不具合が生じた場合には、刺激部位から前後左右(内
外側)に 0.5cm 程度コイルを移動、もしくはコイル交点を中心に-5~+5 度回転させ、上記
の自覚症状を軽減させる。けいれん発作が生じた場合には、rTMS 療法を中止して経過観察
を行い、けいれん発作が消失することを確認する。軽躁・躁転が生じた場合には、rTMS 療
法を中止し、必要に応じて適切な薬物療法の導入を検討する。
医療機器の概要や副作用についての詳細は添付文書を参照のこと。
試験機器の適用方法
本研究では、維持療法期の前半 6 か月は週 1 日の rTMS 療法を行い、後半 6 か月は隔週 1
日の rTMS 療法を行う。刺激部位、刺激強度、刺激頻度、刺激回数などの刺激条件は、急性
期のものと同一とし、左前頭前野、120% MT、10 Hz、3,000 pulses であり、日本精神神経
学会の rTMS 適正使用指針に準拠する。ほか、規定されていない事項については、必要に応
じて本研究の運営委員会にて決める。なお、研究計画書に追記、修正したうえで、臨床研
究審査委員会および先進医療技術審査部会の承認を得る。
併用薬・併用療法についての規定
薬物療法は、原則として維持療法期間中は同一条件(用量、投与回数、時間など)にて
継続する。用法・用量は、各向精神薬の添付文書に準拠し、単剤投与を推奨する。なお、
規定されていない事項については、必要に応じて本研究の運営委員会にて決める。なお、
36