よむ、つかう、まなぶ。
別紙3 (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
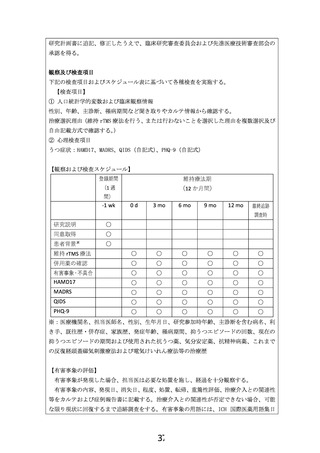
本研究に参加した場合、12 か月間の通院加療が求められる。さらに維持 rTMS 療法を希
望する場合は、前半 6 か月は毎週の頻度で通院すること、後半 6 か月は隔週の頻度で通院
することが求められる。したがって、通院に要する相応の労力および時間、経済的出費等
が生じると考えられる。
(2)研究対象者に生じ得る不利益(疾病等、不具合等)
rTMS 療法の既知の副作用としては、頭痛、刺激部位の疼痛、刺激部位の不快感、筋収縮
の有無などが 20-40%の頻度で報告されている(鬼頭, 2015)
。また、稀に 0.1%未満の頻
度でけいれん発作が生じることがある(鬼頭, 2015)。また、rTMS 療法中に、治療を要する
ような軽躁・躁病エピソードが発生する頻度は、実刺激群で 0.84%、偽刺激群で 0.74%と報
告されている(Xia et al., 2008)。
(3)リスクを最小化する方法
本研究に参加にすることにより投与された薬剤、もしくは医療機器の不具合によって起
こったことが疑われる疾病、障害もしくは死亡又は感染症を「疾病等」と定義する。病等
以外で、研究参加に伴って起こった全ての好ましくない又は意図しない傷病若しくはその
徴候(臨床検査値の異常を含む)を「有害事象」と定義する。試験機器の具合がよくない
ことを「不具合」と定義する。
①安全性モニタリング
刺激実施毎に担当した医師が終了後診察を行い、疾病等の評価を行う。医師は、安全評
価質問票の内容を本人に確認してもらい、症状の有無、重症度、治療介入との関連につい
て評価し記入する。
②疾病等発生時の対応
a)共通する対応、発生前の対応
本臨床試験参加者に臨床試験参加カードを配布し、疾病等発生時の連絡先などを明記す
る。試験参加者の当院電子カルテ内に、試験参加中であること、疾病等発生時の対応方法
について記載を行う。また、当直医師にも書面にて試験参加中の参加者の疾病等に対する
対応方法の書類を配布する。すべての疾病等について、医師は診療録に事象名、発現日、
重篤度、程度、処置の有無、転帰、及び研究との因果関係について記載を行う。
b)軽微な疾病等が発生した場合
発見者は速やかに研究責任医師に報告する。発生時は速やかに適切な診察と処置を行う。
c)重篤な疾病等が発生した場合
発見者は速やかに研究責任医師に報告する。研究責任医師または刺激を担当した医師は
速やかに診察と処置を行う。研究責任医師は実施医療機関の管理者、及び厚生労働省に報
告する。原則として、重大な疾病等が生じた場合は対象者の試験参加中止を検討する。
③効果安全性評価委員会
本研究の実施にあたり、効果安全性評価委員会を設置する。未知の有害事象および重篤
な有害事象が発生した際には、研究代表者が必要と認めた場合において速やかに同委員会
40
望する場合は、前半 6 か月は毎週の頻度で通院すること、後半 6 か月は隔週の頻度で通院
することが求められる。したがって、通院に要する相応の労力および時間、経済的出費等
が生じると考えられる。
(2)研究対象者に生じ得る不利益(疾病等、不具合等)
rTMS 療法の既知の副作用としては、頭痛、刺激部位の疼痛、刺激部位の不快感、筋収縮
の有無などが 20-40%の頻度で報告されている(鬼頭, 2015)
。また、稀に 0.1%未満の頻
度でけいれん発作が生じることがある(鬼頭, 2015)。また、rTMS 療法中に、治療を要する
ような軽躁・躁病エピソードが発生する頻度は、実刺激群で 0.84%、偽刺激群で 0.74%と報
告されている(Xia et al., 2008)。
(3)リスクを最小化する方法
本研究に参加にすることにより投与された薬剤、もしくは医療機器の不具合によって起
こったことが疑われる疾病、障害もしくは死亡又は感染症を「疾病等」と定義する。病等
以外で、研究参加に伴って起こった全ての好ましくない又は意図しない傷病若しくはその
徴候(臨床検査値の異常を含む)を「有害事象」と定義する。試験機器の具合がよくない
ことを「不具合」と定義する。
①安全性モニタリング
刺激実施毎に担当した医師が終了後診察を行い、疾病等の評価を行う。医師は、安全評
価質問票の内容を本人に確認してもらい、症状の有無、重症度、治療介入との関連につい
て評価し記入する。
②疾病等発生時の対応
a)共通する対応、発生前の対応
本臨床試験参加者に臨床試験参加カードを配布し、疾病等発生時の連絡先などを明記す
る。試験参加者の当院電子カルテ内に、試験参加中であること、疾病等発生時の対応方法
について記載を行う。また、当直医師にも書面にて試験参加中の参加者の疾病等に対する
対応方法の書類を配布する。すべての疾病等について、医師は診療録に事象名、発現日、
重篤度、程度、処置の有無、転帰、及び研究との因果関係について記載を行う。
b)軽微な疾病等が発生した場合
発見者は速やかに研究責任医師に報告する。発生時は速やかに適切な診察と処置を行う。
c)重篤な疾病等が発生した場合
発見者は速やかに研究責任医師に報告する。研究責任医師または刺激を担当した医師は
速やかに診察と処置を行う。研究責任医師は実施医療機関の管理者、及び厚生労働省に報
告する。原則として、重大な疾病等が生じた場合は対象者の試験参加中止を検討する。
③効果安全性評価委員会
本研究の実施にあたり、効果安全性評価委員会を設置する。未知の有害事象および重篤
な有害事象が発生した際には、研究代表者が必要と認めた場合において速やかに同委員会
40