よむ、つかう、まなぶ。
別紙3 (43 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00042.html |
| 出典情報 | 先進医療会議(第108回先進医療会議、第129回先進医療技術審査部会 3/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
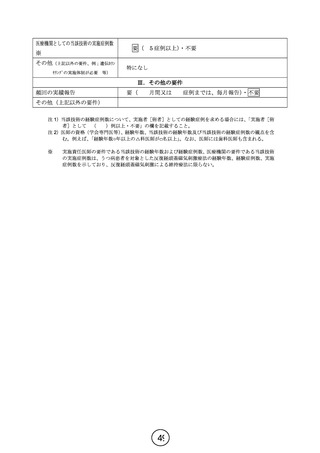
ター 特定臨床研究に係る疾病等及び不具合発生時の手順書」に従う。
なお、当該臨床研究に係る重篤な疾病等とは、以下のいずれかに該当するものをいう。
一 死亡
二 死亡につながる恐れのある疾病等
三 治療のために医療機関への入院または入院期間の延長が必要とされる疾病等
四 障害
五 障害につながる恐れのある疾病等
六 三から五まで並びに死亡及び死亡につながる恐れのある疾病等に準じて重篤である
疾病等
七 後世代による先天性の疾病または異常
また、研究責任医師は、臨床研究法に準じて、当該臨床研究に用いる医療機器の不具合
の発生によって以下の疾病等が発生するおそれがあるものについて知った時には、理事長
に報告の上、これを知った日から30日以内に国立精神神経医療研究センター
認定臨床
研究審査委員会、厚生労働大臣及び医薬品医療機器総合機構に報告を行う。また、研究責
任医師は、同時に披験機器等の製造販売をし、又はしようとする医療機器等製造販売業者
に情報提供を行う。
一
死亡
二
死亡につながる恐れのある疾病等
三
治療のために医療機関への入院又は入院期間の延長が必要とされる疾病等
四
障害
五
障害につながるおそれのある疾病等
六
三から五まで並びに死亡につながる恐れのある疾病等に準じて重篤である疾病等
七
後世代による先天性の疾病又は異常
安全性情報の取り扱い
(1)有害事象
本研究では、研究対象者に生じたあらゆる好ましくない医療上の出来事を有害事象と定
義する。必ずしも当該医薬品の投与及び医療機器等と因果関係が明らかなもののみを示す
ものではない。つまり、有害事象とは、当該医薬品が投与された際におこる、又は医療機
器等によるあらゆる好ましくないあるいは意図しない徴候(臨床検査値の異常を含む)
、症
状、又は病気のことであり、当該医薬品及び医療機器等との因果関係の有無は問わない。
なお、同意取得後から当該医薬品投与又は医療機器等使用開始までに存在した疾患、症状、
又は徴候が当該医薬品投与後又は医療機器等開始後に悪化した場合も有害事象として取扱
う。
(2)副作用
副作用とは、有害事象のうち、当該医薬品又は医療機器等との因果関係を否定すること
が出来ない事象と定義する。
43
なお、当該臨床研究に係る重篤な疾病等とは、以下のいずれかに該当するものをいう。
一 死亡
二 死亡につながる恐れのある疾病等
三 治療のために医療機関への入院または入院期間の延長が必要とされる疾病等
四 障害
五 障害につながる恐れのある疾病等
六 三から五まで並びに死亡及び死亡につながる恐れのある疾病等に準じて重篤である
疾病等
七 後世代による先天性の疾病または異常
また、研究責任医師は、臨床研究法に準じて、当該臨床研究に用いる医療機器の不具合
の発生によって以下の疾病等が発生するおそれがあるものについて知った時には、理事長
に報告の上、これを知った日から30日以内に国立精神神経医療研究センター
認定臨床
研究審査委員会、厚生労働大臣及び医薬品医療機器総合機構に報告を行う。また、研究責
任医師は、同時に披験機器等の製造販売をし、又はしようとする医療機器等製造販売業者
に情報提供を行う。
一
死亡
二
死亡につながる恐れのある疾病等
三
治療のために医療機関への入院又は入院期間の延長が必要とされる疾病等
四
障害
五
障害につながるおそれのある疾病等
六
三から五まで並びに死亡につながる恐れのある疾病等に準じて重篤である疾病等
七
後世代による先天性の疾病又は異常
安全性情報の取り扱い
(1)有害事象
本研究では、研究対象者に生じたあらゆる好ましくない医療上の出来事を有害事象と定
義する。必ずしも当該医薬品の投与及び医療機器等と因果関係が明らかなもののみを示す
ものではない。つまり、有害事象とは、当該医薬品が投与された際におこる、又は医療機
器等によるあらゆる好ましくないあるいは意図しない徴候(臨床検査値の異常を含む)
、症
状、又は病気のことであり、当該医薬品及び医療機器等との因果関係の有無は問わない。
なお、同意取得後から当該医薬品投与又は医療機器等使用開始までに存在した疾患、症状、
又は徴候が当該医薬品投与後又は医療機器等開始後に悪化した場合も有害事象として取扱
う。
(2)副作用
副作用とは、有害事象のうち、当該医薬品又は医療機器等との因果関係を否定すること
が出来ない事象と定義する。
43