よむ、つかう、まなぶ。
資料4-3 機関評価結果及び対処方針 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26761.html |
| 出典情報 | 厚生科学審議会科学技術部会(第130回 7/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
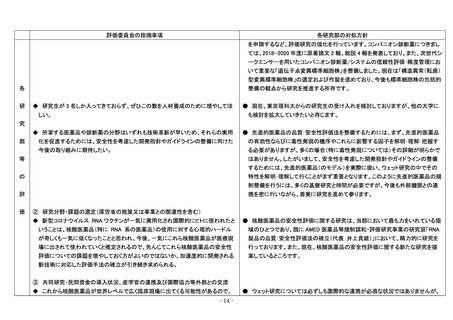
評価委員会の指摘事項
各研究部の対処方針
医療機器部は業務遂行のために要求される研究分野が多岐に渡る特徴がありま
す。定員削減が進む中、正規職員の純増は厳しい状況ですが、各分野の専門家を
配置した上で、室単位を基本として横の連携を図り、技術と知識を共有していま
す。限られた人的リソースで最大限の効果を得るため、非常勤職員・派遣職員の
雇用、研究生・ポスドクの受け入れを推進しています。所内研究部、大学等の外部
各
研究機関及び業界団体との連携強化も重要であり、今後、連携先の拡大、連携内
容の効率化等を推進します。また、教授、准教授クラス等のアカデミアを客員又は
研
協力研究者として迎え、部員の育成に努めると共に、ガイドライン作成事業や講義
等を通じた人材育成、レギュラトリーサイエンスの普及にも更に注力します。
究
◆ 海外研究機関における医療機器の進展も凄まじいので、より積極的に国際化を目
部
● 国産医療機器の開発促進と海外展開にあたり、産官学による新規評価法の開発
指し、国際共同研究を行っていくようにされたい。
とその国際標準化は国家戦略の一つに掲げられていますので、今後も強力に推進
革新的医療機器の開発促進のための国際標準化に向けた取り組みに期待したい。
します。特に ISO 規格の発行にあたっては、国際ラウンドロビンテストを実施するこ
等
とも少なくありませんので、海外の大学、研究機関、関連企業とも連携して、日本発
の評価法の標準化等を引き続き推進します。
の
● 研究課題は、レギュラトリーサイエンスの視点から、常に規制当局(厚労省、
② 研究分野・課題の選定(厚労省の施策又は事業との関連性を含む)
評
価
◆ あまりに様々な機材があるので、その中でなぜ特定の機器を研究調査対象として
PMDA)及び業界等のニーズを踏まえて選定しています。基本的には、その時々に
選抜したのか、していくのかの基準がわからない(難しい)。ぜひ安全性に軸足を置
対応すべき製品群の安全性評価手法の開発と既存評価法の改良等が主な業務と
いて進めていかれたい。
なります。一方、安全性評価研究においては、製品開発に繋がるシーズが獲られ
ることもありますので、新たな知見を見逃すことなく、所掌業務の一つである「試験
的製造」に繋げて行きます。
(6)遺伝子医薬部
① 研究、試験、調査及び人材養成等の状況と成果(厚労省の施策又は事業への貢
献を含む)
◆ 次世代分子標的薬やコンパニオン診断薬の評価に関して、積極的な研究推進、情
● 次世代分子標的薬につきましては、2018−2020 年度に原著論文 8 報、総説 6 報
を発表しており、また、現在、タンパク質分解医薬の新規安全性評価法(ターゲット
報公開が望まれる。
プロテオミクス技術を用いたオフターゲット評価法)の確立に向けて新たな研究費
- 13 -
各研究部の対処方針
医療機器部は業務遂行のために要求される研究分野が多岐に渡る特徴がありま
す。定員削減が進む中、正規職員の純増は厳しい状況ですが、各分野の専門家を
配置した上で、室単位を基本として横の連携を図り、技術と知識を共有していま
す。限られた人的リソースで最大限の効果を得るため、非常勤職員・派遣職員の
雇用、研究生・ポスドクの受け入れを推進しています。所内研究部、大学等の外部
各
研究機関及び業界団体との連携強化も重要であり、今後、連携先の拡大、連携内
容の効率化等を推進します。また、教授、准教授クラス等のアカデミアを客員又は
研
協力研究者として迎え、部員の育成に努めると共に、ガイドライン作成事業や講義
等を通じた人材育成、レギュラトリーサイエンスの普及にも更に注力します。
究
◆ 海外研究機関における医療機器の進展も凄まじいので、より積極的に国際化を目
部
● 国産医療機器の開発促進と海外展開にあたり、産官学による新規評価法の開発
指し、国際共同研究を行っていくようにされたい。
とその国際標準化は国家戦略の一つに掲げられていますので、今後も強力に推進
革新的医療機器の開発促進のための国際標準化に向けた取り組みに期待したい。
します。特に ISO 規格の発行にあたっては、国際ラウンドロビンテストを実施するこ
等
とも少なくありませんので、海外の大学、研究機関、関連企業とも連携して、日本発
の評価法の標準化等を引き続き推進します。
の
● 研究課題は、レギュラトリーサイエンスの視点から、常に規制当局(厚労省、
② 研究分野・課題の選定(厚労省の施策又は事業との関連性を含む)
評
価
◆ あまりに様々な機材があるので、その中でなぜ特定の機器を研究調査対象として
PMDA)及び業界等のニーズを踏まえて選定しています。基本的には、その時々に
選抜したのか、していくのかの基準がわからない(難しい)。ぜひ安全性に軸足を置
対応すべき製品群の安全性評価手法の開発と既存評価法の改良等が主な業務と
いて進めていかれたい。
なります。一方、安全性評価研究においては、製品開発に繋がるシーズが獲られ
ることもありますので、新たな知見を見逃すことなく、所掌業務の一つである「試験
的製造」に繋げて行きます。
(6)遺伝子医薬部
① 研究、試験、調査及び人材養成等の状況と成果(厚労省の施策又は事業への貢
献を含む)
◆ 次世代分子標的薬やコンパニオン診断薬の評価に関して、積極的な研究推進、情
● 次世代分子標的薬につきましては、2018−2020 年度に原著論文 8 報、総説 6 報
を発表しており、また、現在、タンパク質分解医薬の新規安全性評価法(ターゲット
報公開が望まれる。
プロテオミクス技術を用いたオフターゲット評価法)の確立に向けて新たな研究費
- 13 -