よむ、つかう、まなぶ。
資料4-3 機関評価結果及び対処方針 (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26761.html |
| 出典情報 | 厚生科学審議会科学技術部会(第130回 7/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
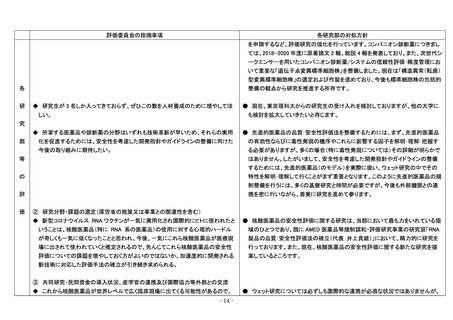
評価委員会の指摘事項
各研究部の対処方針
(1)薬品部
① 研究、試験、調査及び人材養成等の状況と成果(これらの厚労省の施策又は事業
への貢献を含む)
● 重要性の高い研究領域の増員に行政の認知が得られるよう努力します。DDS 製
◆ 今後、ナノDDS評価などを実施する研究員の確保が課題。
剤の評価法については、来年度の人員要求で認められた後発品関連の増員枠で
各
研
も一部検討を進めます。
◆ 人数が少ないだけに研究の切り替わり時期等で大きく影響を受けるのかとも思う
が、次の原著論文につながる成果が減っているのではないかと危惧している。
究
● ご指摘のように行政課題の変化にあわせつつ、競争力のある研究を進める事に
苦心しています。2021 年から AMED 研究として開始した変異原性微量不純物の管
理法研究では、分析法を中心に新たな領域の論文が受理されつつあります。今後
も必要な領域で研究成果が得られるよう、企画段階からの調整に努力します。
部
② 研究分野・課題の選定(厚労省の施策又は事業との関連性を含む)
等
の
◆ 主な研究で、「生物学的同等性試験法ガイドライン」として、「局所皮膚適用製剤」と
● 生物学的同等性試験ガイドラインについては、経口製剤から順次検討を進めて
「腸溶解製剤の評価法」の2種としているが、薬品部としてこの2種だけてよいのか検
行政 GL としてきました。今期は臨床系の学会等からの非同等リスクの指摘と、基
討が必要と思われる。
本 GL に加えた評価設定が必要と考えられた製剤領域として2分野を対象としまし
た。2022 年度からは ICH 国際調和の進展に合わせ、経口製剤評価での溶出試験
活用について検討をする予定です。
評
価
◆ 後発薬品製造会社の重大トラブルが発生している折、ジェネリックについての研
● 薬品部では関連部と共同で、発がん性不純物や GMP 違反による品質問題によ
り 1 ヶ月以上の緊急試験を 2018-20 年度に 4 件担当しました。企業の工程管理見
究・調査と安全性担保の役割はますます重要になると思われる。
直しにより、大規模な GMP 問題は収束することを期待しています。今後も製品評価
法の標準化と工程管理法の研究、流通品試験を柱として、行政および地方衛生研
究所と情報を共有しながら作業を進めます。
◆ 現在 Covid-19 ワクチンの製剤特性が非常に関心を集めており、こうした社会的ト
● 薬品部では COVID-19 ワクチンに関して、金属不純物混入案件(モデルナ)に対
する所内各部との緊急研究に参加(異物評価を担当)するとともに、行政による規
ピックスへの研究展開もできる限り意識されるべきであろう。
格評価や安定性に関する情報提供に協力しました。今後に向けて、医薬品として
の活用を含めた脂質ナノ粒子製剤の物性評価法や安定化技術を対象に検討を開
-7-
各研究部の対処方針
(1)薬品部
① 研究、試験、調査及び人材養成等の状況と成果(これらの厚労省の施策又は事業
への貢献を含む)
● 重要性の高い研究領域の増員に行政の認知が得られるよう努力します。DDS 製
◆ 今後、ナノDDS評価などを実施する研究員の確保が課題。
剤の評価法については、来年度の人員要求で認められた後発品関連の増員枠で
各
研
も一部検討を進めます。
◆ 人数が少ないだけに研究の切り替わり時期等で大きく影響を受けるのかとも思う
が、次の原著論文につながる成果が減っているのではないかと危惧している。
究
● ご指摘のように行政課題の変化にあわせつつ、競争力のある研究を進める事に
苦心しています。2021 年から AMED 研究として開始した変異原性微量不純物の管
理法研究では、分析法を中心に新たな領域の論文が受理されつつあります。今後
も必要な領域で研究成果が得られるよう、企画段階からの調整に努力します。
部
② 研究分野・課題の選定(厚労省の施策又は事業との関連性を含む)
等
の
◆ 主な研究で、「生物学的同等性試験法ガイドライン」として、「局所皮膚適用製剤」と
● 生物学的同等性試験ガイドラインについては、経口製剤から順次検討を進めて
「腸溶解製剤の評価法」の2種としているが、薬品部としてこの2種だけてよいのか検
行政 GL としてきました。今期は臨床系の学会等からの非同等リスクの指摘と、基
討が必要と思われる。
本 GL に加えた評価設定が必要と考えられた製剤領域として2分野を対象としまし
た。2022 年度からは ICH 国際調和の進展に合わせ、経口製剤評価での溶出試験
活用について検討をする予定です。
評
価
◆ 後発薬品製造会社の重大トラブルが発生している折、ジェネリックについての研
● 薬品部では関連部と共同で、発がん性不純物や GMP 違反による品質問題によ
り 1 ヶ月以上の緊急試験を 2018-20 年度に 4 件担当しました。企業の工程管理見
究・調査と安全性担保の役割はますます重要になると思われる。
直しにより、大規模な GMP 問題は収束することを期待しています。今後も製品評価
法の標準化と工程管理法の研究、流通品試験を柱として、行政および地方衛生研
究所と情報を共有しながら作業を進めます。
◆ 現在 Covid-19 ワクチンの製剤特性が非常に関心を集めており、こうした社会的ト
● 薬品部では COVID-19 ワクチンに関して、金属不純物混入案件(モデルナ)に対
する所内各部との緊急研究に参加(異物評価を担当)するとともに、行政による規
ピックスへの研究展開もできる限り意識されるべきであろう。
格評価や安定性に関する情報提供に協力しました。今後に向けて、医薬品として
の活用を含めた脂質ナノ粒子製剤の物性評価法や安定化技術を対象に検討を開
-7-