よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00051.html |
| 出典情報 | 先進医療会議(第115回 10/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
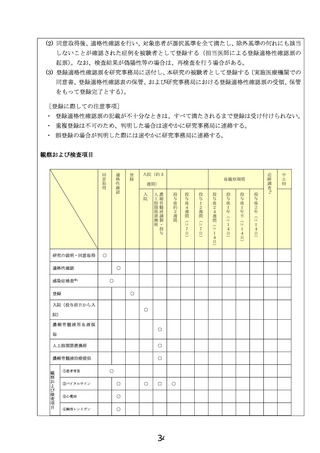
先進医療会議からの指摘事項に対する回答1
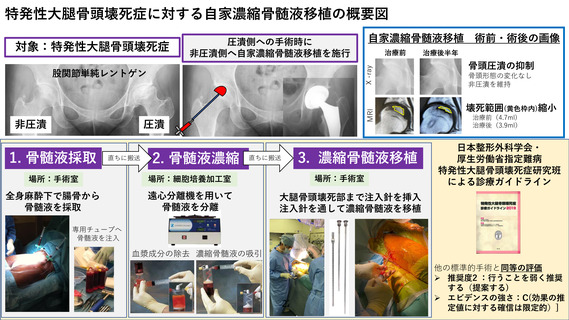
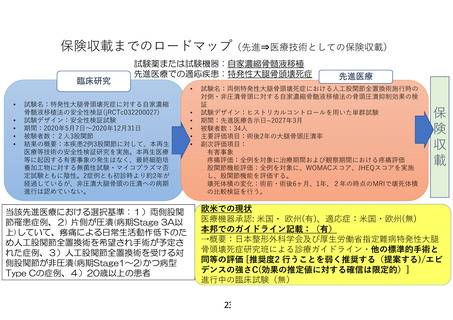
先進医療技術名:特発性大腿骨頭壊死症に対する自家濃縮骨髄液移植
令和 4 年 9 月 28 日
所属:順天堂大学医学部附属順天堂医院 整形外科
氏名:本間 康弘
以下の点について検討し,必要に応じて関連書類についても修正してください.
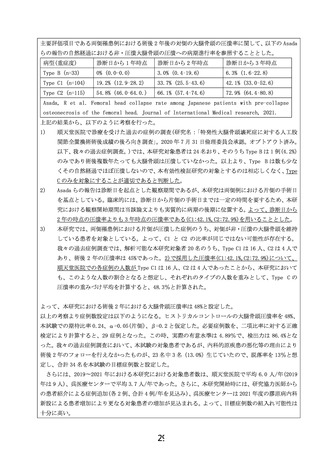
1. 実施届出書について
実施届出書、様式第1−1号(p1)の実施責任医師の所属は『整形外科・スポーツ診療科』
と記入されています。一方、様式第2号(p2)の先進医療の実施診療科及び実施体制の「1.
申請医療機関」については、申請医療機関の実施診療科は、『整形外科』となっております。
『整形外科・スポーツ診療科』と『整形外科』の関係が、この文書の中からは理解できず、整合
性をとっていただくか、整形外科と整形外科・スポーツ診療科の関係に関する説明が必要で
あると考えます。ご説明願います。
【回答】
ご指摘ありがとうございます。正式届出名称は、
「整形外科」になりますので、全て届
出名称を用いることといたします。
2.実施届出書について
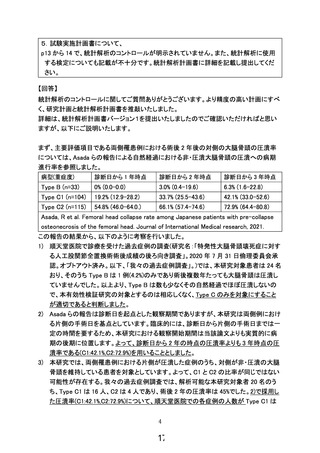
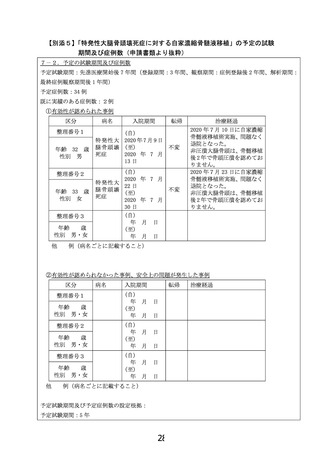
骨髄液量の下限:実施届出書の様式第3号「6.治療計画」についてです。
「特定再
生加工物の概要(p9)」には、骨髄液薬 165mL 採取を目的と記載されています。続けて
7行目以降に、
『また、規定量の骨髄液が採取できない場合の最低量に関しては』とい
う記載があり、そこでは『片側約 108mL とするとなっています。ただし、1時間以上の
骨髄穿刺を行なっても規定量に達しない場合、その時点での採取量を限度とし、遠心分
離操作後の濃縮骨髄液全てを投与に用いることとする。』とあり、事実上、下限設定と
はなっていない点が懸念されます。ごく少量の場合においても患者組み入れを行うと
いうことでしょうか。ご説明願います。
また、片側 108mL と、
『片側』という記載もその意味が理解できません。さらに、そ
の際には、出荷判定基準には含まれないものの安全性上重要と考えられる品質試験(無
菌試験、マイコプラズマ否定試験、エンドトキシン試験)を実施せず、とあり、この点
は、試験全体の安全性を考える上で問題とならないでしょうか?ご説明願います。
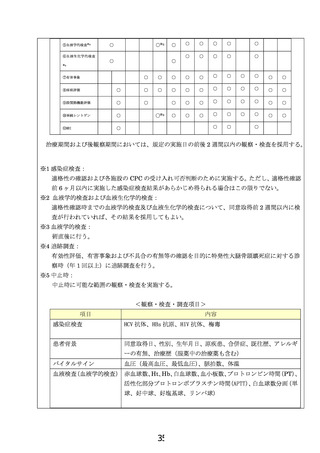
2
先進医療技術名:特発性大腿骨頭壊死症に対する自家濃縮骨髄液移植
令和 4 年 9 月 28 日
所属:順天堂大学医学部附属順天堂医院 整形外科
氏名:本間 康弘
以下の点について検討し,必要に応じて関連書類についても修正してください.
1. 実施届出書について
実施届出書、様式第1−1号(p1)の実施責任医師の所属は『整形外科・スポーツ診療科』
と記入されています。一方、様式第2号(p2)の先進医療の実施診療科及び実施体制の「1.
申請医療機関」については、申請医療機関の実施診療科は、『整形外科』となっております。
『整形外科・スポーツ診療科』と『整形外科』の関係が、この文書の中からは理解できず、整合
性をとっていただくか、整形外科と整形外科・スポーツ診療科の関係に関する説明が必要で
あると考えます。ご説明願います。
【回答】
ご指摘ありがとうございます。正式届出名称は、
「整形外科」になりますので、全て届
出名称を用いることといたします。
2.実施届出書について
骨髄液量の下限:実施届出書の様式第3号「6.治療計画」についてです。
「特定再
生加工物の概要(p9)」には、骨髄液薬 165mL 採取を目的と記載されています。続けて
7行目以降に、
『また、規定量の骨髄液が採取できない場合の最低量に関しては』とい
う記載があり、そこでは『片側約 108mL とするとなっています。ただし、1時間以上の
骨髄穿刺を行なっても規定量に達しない場合、その時点での採取量を限度とし、遠心分
離操作後の濃縮骨髄液全てを投与に用いることとする。』とあり、事実上、下限設定と
はなっていない点が懸念されます。ごく少量の場合においても患者組み入れを行うと
いうことでしょうか。ご説明願います。
また、片側 108mL と、
『片側』という記載もその意味が理解できません。さらに、そ
の際には、出荷判定基準には含まれないものの安全性上重要と考えられる品質試験(無
菌試験、マイコプラズマ否定試験、エンドトキシン試験)を実施せず、とあり、この点
は、試験全体の安全性を考える上で問題とならないでしょうか?ご説明願います。
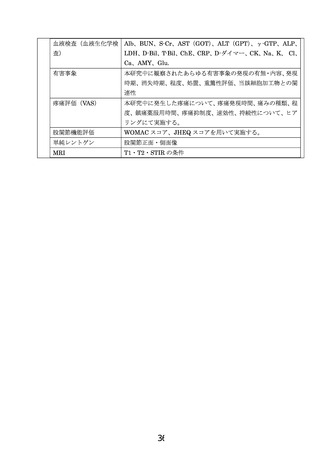
2