よむ、つかう、まなぶ。
別紙4○先進医療Bに係る新規技術の科学的評価等について (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00051.html |
| 出典情報 | 先進医療会議(第115回 10/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
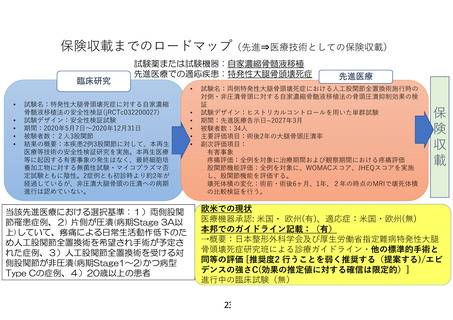
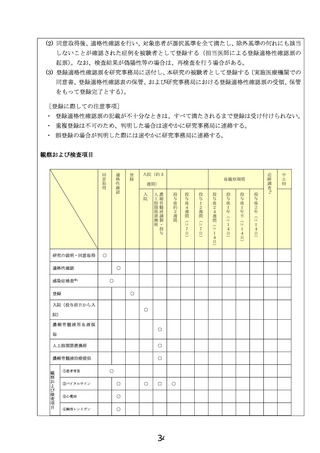
保険収載までのロードマップ(先進⇒医療技術としての保険収載)
臨床研究
•
•
•
•
•
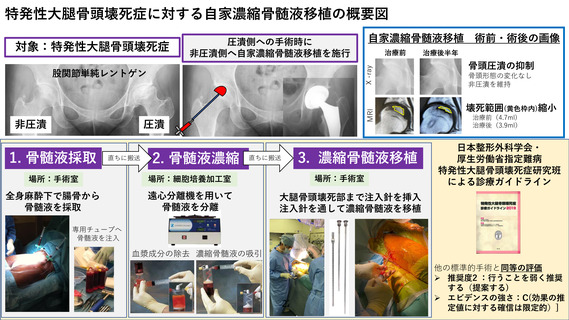
試験薬または試験機器:自家濃縮骨髄液移植
先進医療での適応疾患:特発性大腿骨頭壊死症
試験名:特発性大腿骨頭壊死症に対する自家濃縮
骨髄液移植法の安全性検証(jRCTc032200027)
試験デザイン:安全性検証試験
期間:2020年5月7日~2020年12月31日
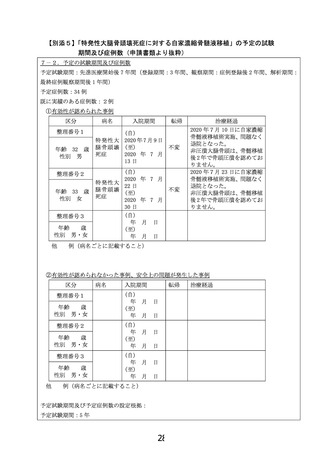
被験者数:2人3股関節
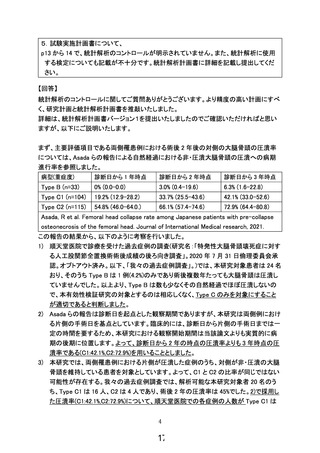
結果の概要:本疾患2例3股関節に対して、本再生
医療等技術の安全性検証研究を実施。本再生医療
等に起因する有害事象の発生はなく、最終細胞培
養加工物に対する無菌性試験・マイコプラズマ否
定試験ともに陰性。2症例とも初診時より約2年が
経過しているが、非圧潰大腿骨頭の圧潰への病期
進行は認めていない。
当該先進医療における選択基準:1)両側股関
節罹患症例、2) 片側が圧潰(病期Stage 3A以
上)していて、疼痛による日常生活動作低下のた
め人工股関節全置換術を希望され手術が予定さ
れた症例、3)人工股関節全置換術を受ける対
側股関節が非圧潰(病期Stage1〜2)かつ病型
Type Cの症例、4)20歳以上の患者
•
•
•
•
•
•
先進医療
試験名:両側特発性大腿骨頭壊死症における人工股関節全置換術施行時の
対側・非圧潰骨頭に対する自家濃縮骨髄液移植法の骨頭圧潰抑制効果の検
証
試験デザイン:ヒストリカルコントロールを用いた単群試験
期間:先進医療告示日~2027年3月
被験者数:34人
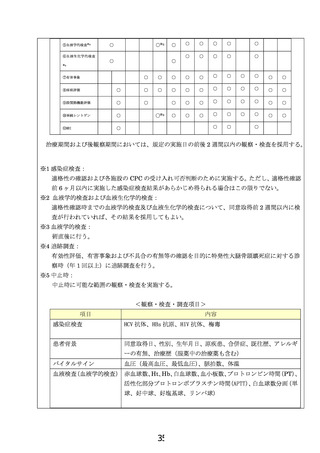
主要評価項目:術後2年の大腿骨頭圧潰率
副次評価項目:
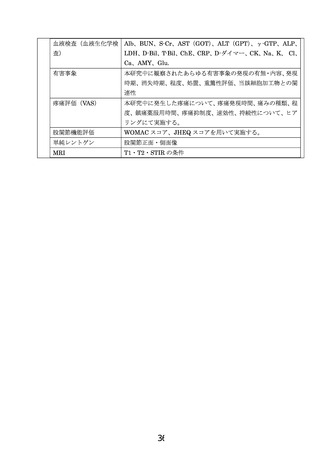
有害事象
疼痛評価:全例を対象に治療期間および観察期間における疼痛評価
股関節機能評価:全例を対象に、WOMACスコア、JHEQスコアを実施
し、股関節機能を評価する。
壊死体積の変化:術前・術後6ヶ月、1年、2年の時点のMRIで壊死体積
の比較検証を行う。
保
険
収
載
欧米での現状
医療機器承認: 米国・ 欧州(有)、適応症:米国・欧州(無)
本邦でのガイドライン記載:(有)
→概要:日本整形外科学会及び厚生労働省指定難病特発性大腿
骨頭壊死症研究班による診療ガイドライン・他の標準的手術と
同等の評価 [推奨度2 行うことを弱く推奨する(提案する)/エビ
デンスの強さC(効果の推定値に対する確信は限定的)]
進行中の臨床試験(無)
23
臨床研究
•
•
•
•
•
試験薬または試験機器:自家濃縮骨髄液移植
先進医療での適応疾患:特発性大腿骨頭壊死症
試験名:特発性大腿骨頭壊死症に対する自家濃縮
骨髄液移植法の安全性検証(jRCTc032200027)
試験デザイン:安全性検証試験
期間:2020年5月7日~2020年12月31日
被験者数:2人3股関節
結果の概要:本疾患2例3股関節に対して、本再生
医療等技術の安全性検証研究を実施。本再生医療
等に起因する有害事象の発生はなく、最終細胞培
養加工物に対する無菌性試験・マイコプラズマ否
定試験ともに陰性。2症例とも初診時より約2年が
経過しているが、非圧潰大腿骨頭の圧潰への病期
進行は認めていない。
当該先進医療における選択基準:1)両側股関
節罹患症例、2) 片側が圧潰(病期Stage 3A以
上)していて、疼痛による日常生活動作低下のた
め人工股関節全置換術を希望され手術が予定さ
れた症例、3)人工股関節全置換術を受ける対
側股関節が非圧潰(病期Stage1〜2)かつ病型
Type Cの症例、4)20歳以上の患者
•
•
•
•
•
•
先進医療
試験名:両側特発性大腿骨頭壊死症における人工股関節全置換術施行時の
対側・非圧潰骨頭に対する自家濃縮骨髄液移植法の骨頭圧潰抑制効果の検
証
試験デザイン:ヒストリカルコントロールを用いた単群試験
期間:先進医療告示日~2027年3月
被験者数:34人
主要評価項目:術後2年の大腿骨頭圧潰率
副次評価項目:
有害事象
疼痛評価:全例を対象に治療期間および観察期間における疼痛評価
股関節機能評価:全例を対象に、WOMACスコア、JHEQスコアを実施
し、股関節機能を評価する。
壊死体積の変化:術前・術後6ヶ月、1年、2年の時点のMRIで壊死体積
の比較検証を行う。
保
険
収
載
欧米での現状
医療機器承認: 米国・ 欧州(有)、適応症:米国・欧州(無)
本邦でのガイドライン記載:(有)
→概要:日本整形外科学会及び厚生労働省指定難病特発性大腿
骨頭壊死症研究班による診療ガイドライン・他の標準的手術と
同等の評価 [推奨度2 行うことを弱く推奨する(提案する)/エビ
デンスの強さC(効果の推定値に対する確信は限定的)]
進行中の臨床試験(無)
23