よむ、つかう、まなぶ。
資料1-2 アムロジピンベシル酸塩 調査結果報告書及び添付文書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
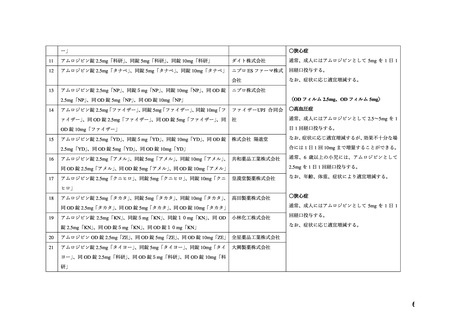
調査結果報告書
令和 4 年 11 月 8 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
[一 般 名]
アムロジピンベシル酸塩
[ 販 売 名 ] 別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、生殖毒性の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦(以下、
「妊婦等」
)への医薬品投与に関する情報の添付文書への反映を推
進する取組を行っている。
アムロジピンベシル酸塩(以下、
「本薬」)は、その先発医薬品の初回承認に係る審査で評
価された非臨床試験において、妊娠末期の投与により妊娠期間及び分娩時間の延長が認め
られたことから、
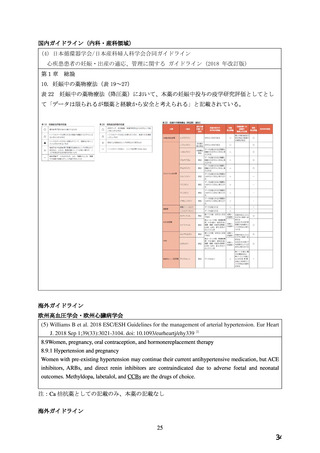
「妊婦又は妊娠している可能性のある女性」が禁忌とされている。
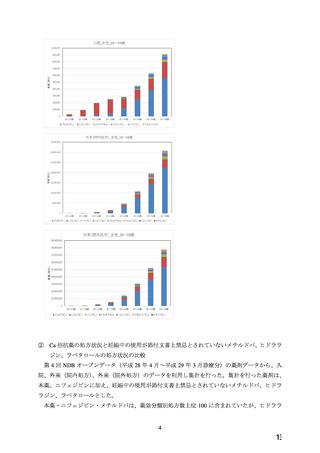
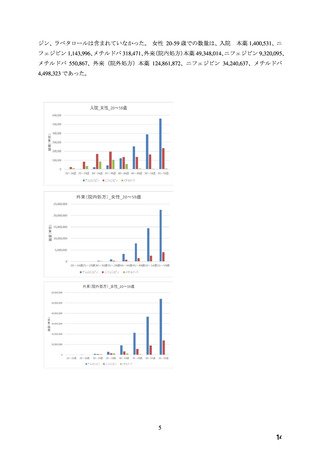
今般、妊娠全期間において厳格な血圧コントロールが求められるようになってきた医療
環境を踏まえ、WG により、積極的適応のない場合の高血圧に対して第一選択薬とされてい
る Ca 拮抗薬のうち医療現場での処方割合の高い本薬について、添付文書の禁忌「妊婦又は
妊娠している可能性のある女性」の適正性が検討され、報告書(以下、「WG 報告書」)
(別
添 2)が取りまとめられた。WG 報告書を受けて、厚生労働省医薬・生活衛生局医薬安全対
策課は、
「医薬品等の安全性に係る調査依頼について」
(令和 4 年 5 月 13 日付薬生安発 0513
第 4 号)により独立行政法人医薬品医療機器総合機構(以下、
「機構」)に本薬の妊産婦等に
係る「使用上の注意」の改訂に関する調査を依頼した。機構は、当該依頼に基づく調査及び添
付文書改訂の必要性の検討を行った。
なお、機構は、本調査において専門協議を実施しており、本専門協議の専門委員は、調査
対象品目についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における
専門協議等の実施に関する達」
(平成 20 年 12 月 25 日付 20 達第 8 号)の規程により、指名
1
医薬品・医療機器等安全性情報 No.355(厚生労働省医薬品・生活衛生局発行)
(https://www.mhlw.go.jp/content/11120000/000307752.pdf)(最終確認:2022 年 9 月 15 日)
1
1
令和 4 年 11 月 8 日
独立行政法人医薬品医療機器総合機構
I.
品目の概要
[一 般 名]
アムロジピンベシル酸塩
[ 販 売 名 ] 別添 1 のとおり
[承認取得者] 別添 1 のとおり
[効能・効果] 別添 1 のとおり
[用法・用量] 別添 1 のとおり
[調査担当部] 医薬品安全対策第一部
II. 今回の調査の経緯
厚生労働省は、
「妊婦・授乳婦を対象とした薬の適正使用推進事業」1において、医師、薬
剤師、生殖毒性の専門家等で構成される情報提供ワーキンググループ(以下、
「WG」
)を設
置し、国立成育医療研究センターの妊娠と薬情報センターに集積された情報等を評価・整理
し、妊婦・授乳婦(以下、
「妊婦等」
)への医薬品投与に関する情報の添付文書への反映を推
進する取組を行っている。
アムロジピンベシル酸塩(以下、
「本薬」)は、その先発医薬品の初回承認に係る審査で評
価された非臨床試験において、妊娠末期の投与により妊娠期間及び分娩時間の延長が認め
られたことから、
「妊婦又は妊娠している可能性のある女性」が禁忌とされている。
今般、妊娠全期間において厳格な血圧コントロールが求められるようになってきた医療
環境を踏まえ、WG により、積極的適応のない場合の高血圧に対して第一選択薬とされてい
る Ca 拮抗薬のうち医療現場での処方割合の高い本薬について、添付文書の禁忌「妊婦又は
妊娠している可能性のある女性」の適正性が検討され、報告書(以下、「WG 報告書」)
(別
添 2)が取りまとめられた。WG 報告書を受けて、厚生労働省医薬・生活衛生局医薬安全対
策課は、
「医薬品等の安全性に係る調査依頼について」
(令和 4 年 5 月 13 日付薬生安発 0513
第 4 号)により独立行政法人医薬品医療機器総合機構(以下、
「機構」)に本薬の妊産婦等に
係る「使用上の注意」の改訂に関する調査を依頼した。機構は、当該依頼に基づく調査及び添
付文書改訂の必要性の検討を行った。
なお、機構は、本調査において専門協議を実施しており、本専門協議の専門委員は、調査
対象品目についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における
専門協議等の実施に関する達」
(平成 20 年 12 月 25 日付 20 達第 8 号)の規程により、指名
1
医薬品・医療機器等安全性情報 No.355(厚生労働省医薬品・生活衛生局発行)
(https://www.mhlw.go.jp/content/11120000/000307752.pdf)(最終確認:2022 年 9 月 15 日)
1
1