よむ、つかう、まなぶ。
資料1-2 アムロジピンベシル酸塩 調査結果報告書及び添付文書 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
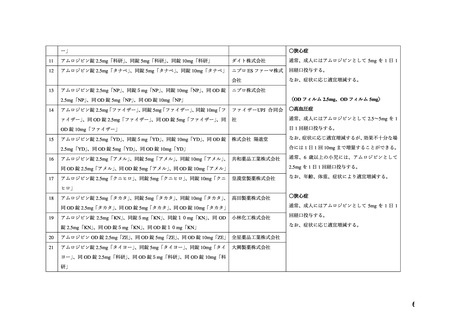
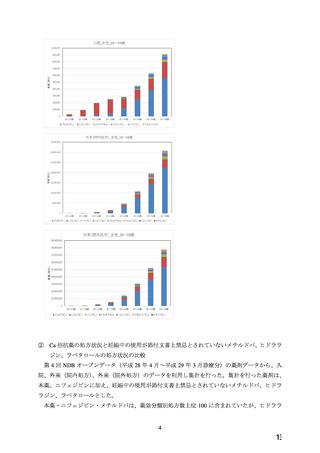
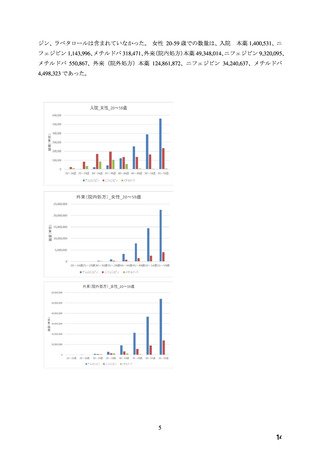
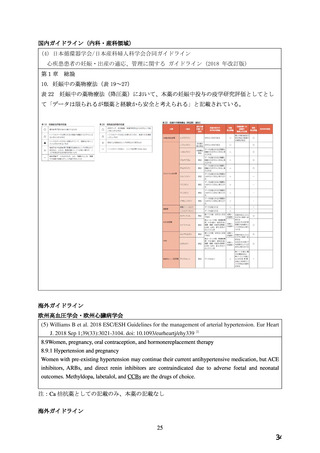
7.禁忌解除の妥当性
ワーキンググループにおいて、以下の理由から、本薬の妊婦への投与については、
「禁忌」の項
から削除し、
「妊婦への投与」の項において「治療上の有益性が危険性を上回ると判断される場合
にのみ投与する」旨の注意喚起を記載することが適切であると判断した。
①高血圧合併妊娠では母体の高血圧腎症や低出生体重児、新生児死亡の割合が高い、など母児の
予後が不良であることが示されている。妊娠高血圧症候群女性 987 人(高血圧合併妊娠 75%、
妊娠高血圧 25%)を対象とした前向き介入研究で、血圧値を低くコントロールした群で母児予
後の改善を認めたため、妊娠全期間において厳格な血圧コントロールが求められるようになっ
てきている。また、妊娠高血圧腎症において、重症域の高血圧発症が死亡と関連していたこと
から、妊娠期間中のより厳格な血圧コントロールが求められるようになっている。本薬は反応
性頻脈などの副作用が少なく、安定した降圧効果が得られること、これまでの報告からは、妊
娠初期の使用による催奇形性の上昇はなく、妊娠中の使用が安全と考えられることから、イン
フォームドコンセントを得たうえで妊娠中にも使用される医薬品として本邦のガイドラインに
記載されている。
②本薬が妊婦禁忌となった根拠は、非臨床試験で妊娠期間と分娩時間の延長を認めたことである
が、本薬のラットを用いた周産期及び授乳期投与試験における、母動物の分娩への影響(難産、
妊娠期間の延長、分娩時間の延長)については、本薬の薬理作用である平滑筋弛緩作用に基づ
く子宮収縮抑制作用に起因したものと考えられる。出生児については、分娩時間の延長に関連
して死産児が増加し、その結果出生率や出生児数が低下したと考えられた。また、生後 4 日生
存率の低下は、母動物の分娩時の影響により分娩直後に母動物が適切な哺育行動をとることが
できなかったことに関連すると推察した。本薬のヒトとラットにおける曝露データを勘案する
と、本薬の薬理作用に起因した母動物の分娩への影響やそれに付随した出生児への影響が認め
られなかった 4 mg/kg/day の用量は、臨床量に比べて十分な曝露マージンが得られているとは
言い難いが、ワーキンググループ委員会にて検討した結果、分娩時間の延長等は、通常の診療
内においても発生することであり、本邦のガイドライン 3等も参考にして、対応することが可能
であると判断した。
③ラット及びウサギを用いた胎児器官形成期投与試験では、Ca 拮抗剤の薬理作用に基づく母動物
の過度な血圧低下に伴う胎盤血流量の減少等により発現すると考えられている胎児致死作用や
催奇形作用は認められなかったが、これは本薬の 25mg/kg/day の用量でも母動物の過度な血圧
低下やそれに伴う胎盤血流量の減少を引き起こさなかったためと推察した。本薬のヒトとラッ
トの曝露データから、ラットに用いられた 25mg/kg/day の用量は臨床量の曝露量に比べて十分
に高い曝露が得られていると考えられること、さらに米国の添付文書において「妊娠ラット及
びウサギに本薬 10mg/kg/day を経口投与しても催奇形作用及び胚胎児毒性は認められず、この
用量は、体表面積換算でヒトの最大臨床推奨用量(MRHD:Maximum recommended human
dose)のそれぞれ 10 倍及び 20 倍に相当する」と記載されていることを考慮すると、これらの
臨床上のリスクは極めて小さいと判断した。
3
「
「産婦人科診療ガイドライン産科編(2020)
」(日本産科婦人科学会/日本産婦人科医会 編集・監修)CQ404 等」
27
36
ワーキンググループにおいて、以下の理由から、本薬の妊婦への投与については、
「禁忌」の項
から削除し、
「妊婦への投与」の項において「治療上の有益性が危険性を上回ると判断される場合
にのみ投与する」旨の注意喚起を記載することが適切であると判断した。
①高血圧合併妊娠では母体の高血圧腎症や低出生体重児、新生児死亡の割合が高い、など母児の
予後が不良であることが示されている。妊娠高血圧症候群女性 987 人(高血圧合併妊娠 75%、
妊娠高血圧 25%)を対象とした前向き介入研究で、血圧値を低くコントロールした群で母児予
後の改善を認めたため、妊娠全期間において厳格な血圧コントロールが求められるようになっ
てきている。また、妊娠高血圧腎症において、重症域の高血圧発症が死亡と関連していたこと
から、妊娠期間中のより厳格な血圧コントロールが求められるようになっている。本薬は反応
性頻脈などの副作用が少なく、安定した降圧効果が得られること、これまでの報告からは、妊
娠初期の使用による催奇形性の上昇はなく、妊娠中の使用が安全と考えられることから、イン
フォームドコンセントを得たうえで妊娠中にも使用される医薬品として本邦のガイドラインに
記載されている。
②本薬が妊婦禁忌となった根拠は、非臨床試験で妊娠期間と分娩時間の延長を認めたことである
が、本薬のラットを用いた周産期及び授乳期投与試験における、母動物の分娩への影響(難産、
妊娠期間の延長、分娩時間の延長)については、本薬の薬理作用である平滑筋弛緩作用に基づ
く子宮収縮抑制作用に起因したものと考えられる。出生児については、分娩時間の延長に関連
して死産児が増加し、その結果出生率や出生児数が低下したと考えられた。また、生後 4 日生
存率の低下は、母動物の分娩時の影響により分娩直後に母動物が適切な哺育行動をとることが
できなかったことに関連すると推察した。本薬のヒトとラットにおける曝露データを勘案する
と、本薬の薬理作用に起因した母動物の分娩への影響やそれに付随した出生児への影響が認め
られなかった 4 mg/kg/day の用量は、臨床量に比べて十分な曝露マージンが得られているとは
言い難いが、ワーキンググループ委員会にて検討した結果、分娩時間の延長等は、通常の診療
内においても発生することであり、本邦のガイドライン 3等も参考にして、対応することが可能
であると判断した。
③ラット及びウサギを用いた胎児器官形成期投与試験では、Ca 拮抗剤の薬理作用に基づく母動物
の過度な血圧低下に伴う胎盤血流量の減少等により発現すると考えられている胎児致死作用や
催奇形作用は認められなかったが、これは本薬の 25mg/kg/day の用量でも母動物の過度な血圧
低下やそれに伴う胎盤血流量の減少を引き起こさなかったためと推察した。本薬のヒトとラッ
トの曝露データから、ラットに用いられた 25mg/kg/day の用量は臨床量の曝露量に比べて十分
に高い曝露が得られていると考えられること、さらに米国の添付文書において「妊娠ラット及
びウサギに本薬 10mg/kg/day を経口投与しても催奇形作用及び胚胎児毒性は認められず、この
用量は、体表面積換算でヒトの最大臨床推奨用量(MRHD:Maximum recommended human
dose)のそれぞれ 10 倍及び 20 倍に相当する」と記載されていることを考慮すると、これらの
臨床上のリスクは極めて小さいと判断した。
3
「
「産婦人科診療ガイドライン産科編(2020)
」(日本産科婦人科学会/日本産婦人科医会 編集・監修)CQ404 等」
27
36