よむ、つかう、まなぶ。
資料1-2 アムロジピンベシル酸塩 調査結果報告書及び添付文書 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29305.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第19回 11/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
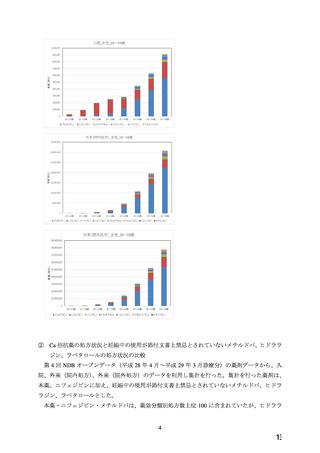
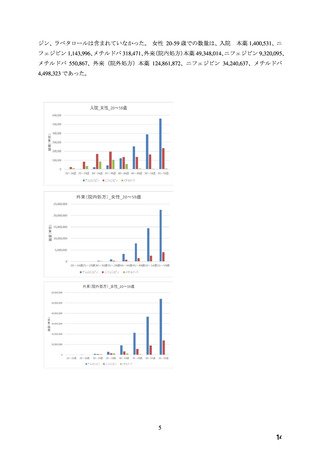
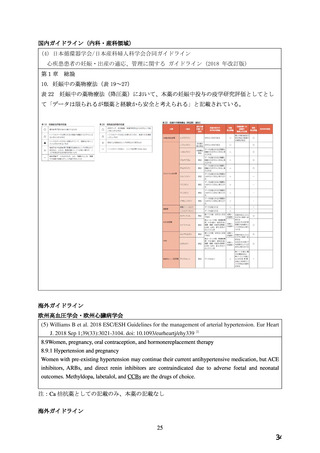
た(検索日:2022 年 6 月 3 日)。抽出された 8 報の内容を確認した結果、Ca 拮抗薬と催奇
形性の関係性を検討した文献は 1 報(下記①の文献)であり、妊娠初期の本薬の曝露による
先天異常のリスク増加は認められなかったという報告であった。
① Safety of Amlodipine in Early Pregnancy(J Am Heart Assoc. 2019; 8: e012093.)
2008 年 4 月~2016 年 7 月に慢性高血圧(chronic hypertension)の妊婦が生児で出産した
231 児を対象として、第 1 三半期に本薬に曝露された 48 児、他の降圧薬に曝露された 54
児、降圧薬に曝露されなかった 129 児を比較したところ、新生児の先天異常の発生割合は、
本薬曝露例 4.2%(2/48 児)
、他の降圧薬曝露例 5.6%(3/54 児)
、降圧薬非曝露例 4.7%(6/129
児)であり、他の降圧薬曝露例に対する本薬曝露例のオッズ比は 0.74(95% CI: 0.118–4.621)
、
非曝露例に対しては 0.89(95% CI: 0.174–4.575)であった。
1-2. 副作用報告
機構の副作用等報告データベースにおける妊娠と新生児に関する本薬の国内副作用症例
報告 3の集積状況は、別添 3 のとおりであり、20 報 35 件の事象が報告された(データロッ
ク日:2022 年 5 月 31 日)
。動物試験から懸念される妊娠期間及び分娩時間の延長に関連す
る報告はなかった。また、先天異常に関連するものとして、左室流出路閉塞、心室中隔欠損
症、心房中隔欠損症、先天異常、先天性鼡径ヘルニア、動静脈奇形、尿道下裂、肥大型心筋
いずれも薬剤が投与された原疾患等の影響も考えられた。
症各 1 件が報告がされているが、
V.
WG 報告書及び「IV. 機構における調査」を踏まえた機構の判断
WG 報告書、上記の「IV. 機構における調査」の結果及び本薬の医療上のニーズを踏まえ
ると、機構は、下の点から、本薬の添付文書の禁忌から「妊婦又は妊娠している可能性のあ
る女性」を削除し、治療上の有益性が危険性を上回ると判断される場合には本薬を妊婦又は
妊娠している可能性のある女性に投与することは可能と判断した。
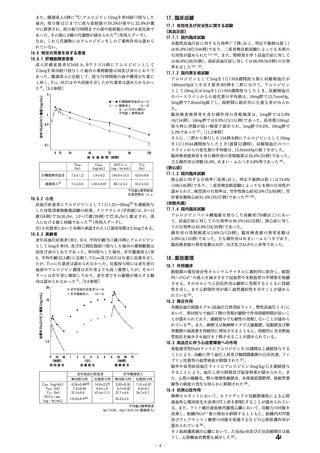
本邦の高血圧治療ガイドラインにおいて、Ca 拮抗薬はアンジオテンシン受容体拮抗薬、
アンジオテンシン変換酵素Ⅱ阻害薬、利尿薬とともに、積極的適応のない場合の高血圧
に対して投与すべき降圧薬(第一選択薬)の一つとされていること(WG 報告書「2. 背
景」参照)
。
副作用報告において、動物試験から懸念された妊娠期間及び分娩時間の延長に関連す
る報告はなかったこと。なお、WG 報告書では、 妊娠期間及び分娩時間の延長につい
ては、通常の診療内においても発生することであり、「産婦人科診療ガイドライン産科
編(2020)
」等も参考にして、対応することが可能であると判断されている(WG 報告
書「7.禁忌解除の妥当性」参照)。
国内外のガイドラインにおいて、本薬の妊婦への使用に関して安全性上の懸念を示す
特段の記載は確認できなかったこと(WG 報告書「6. 国内外のガイドライン」参照)。
3
MedDRA 標準検索式(SMQ)「妊娠と新生児のトピック」に該当する症例を抽出
3
3
形性の関係性を検討した文献は 1 報(下記①の文献)であり、妊娠初期の本薬の曝露による
先天異常のリスク増加は認められなかったという報告であった。
① Safety of Amlodipine in Early Pregnancy(J Am Heart Assoc. 2019; 8: e012093.)
2008 年 4 月~2016 年 7 月に慢性高血圧(chronic hypertension)の妊婦が生児で出産した
231 児を対象として、第 1 三半期に本薬に曝露された 48 児、他の降圧薬に曝露された 54
児、降圧薬に曝露されなかった 129 児を比較したところ、新生児の先天異常の発生割合は、
本薬曝露例 4.2%(2/48 児)
、他の降圧薬曝露例 5.6%(3/54 児)
、降圧薬非曝露例 4.7%(6/129
児)であり、他の降圧薬曝露例に対する本薬曝露例のオッズ比は 0.74(95% CI: 0.118–4.621)
、
非曝露例に対しては 0.89(95% CI: 0.174–4.575)であった。
1-2. 副作用報告
機構の副作用等報告データベースにおける妊娠と新生児に関する本薬の国内副作用症例
報告 3の集積状況は、別添 3 のとおりであり、20 報 35 件の事象が報告された(データロッ
ク日:2022 年 5 月 31 日)
。動物試験から懸念される妊娠期間及び分娩時間の延長に関連す
る報告はなかった。また、先天異常に関連するものとして、左室流出路閉塞、心室中隔欠損
症、心房中隔欠損症、先天異常、先天性鼡径ヘルニア、動静脈奇形、尿道下裂、肥大型心筋
いずれも薬剤が投与された原疾患等の影響も考えられた。
症各 1 件が報告がされているが、
V.
WG 報告書及び「IV. 機構における調査」を踏まえた機構の判断
WG 報告書、上記の「IV. 機構における調査」の結果及び本薬の医療上のニーズを踏まえ
ると、機構は、下の点から、本薬の添付文書の禁忌から「妊婦又は妊娠している可能性のあ
る女性」を削除し、治療上の有益性が危険性を上回ると判断される場合には本薬を妊婦又は
妊娠している可能性のある女性に投与することは可能と判断した。
本邦の高血圧治療ガイドラインにおいて、Ca 拮抗薬はアンジオテンシン受容体拮抗薬、
アンジオテンシン変換酵素Ⅱ阻害薬、利尿薬とともに、積極的適応のない場合の高血圧
に対して投与すべき降圧薬(第一選択薬)の一つとされていること(WG 報告書「2. 背
景」参照)
。
副作用報告において、動物試験から懸念された妊娠期間及び分娩時間の延長に関連す
る報告はなかったこと。なお、WG 報告書では、 妊娠期間及び分娩時間の延長につい
ては、通常の診療内においても発生することであり、「産婦人科診療ガイドライン産科
編(2020)
」等も参考にして、対応することが可能であると判断されている(WG 報告
書「7.禁忌解除の妥当性」参照)。
国内外のガイドラインにおいて、本薬の妊婦への使用に関して安全性上の懸念を示す
特段の記載は確認できなかったこと(WG 報告書「6. 国内外のガイドライン」参照)。
3
MedDRA 標準検索式(SMQ)「妊娠と新生児のトピック」に該当する症例を抽出
3
3