よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
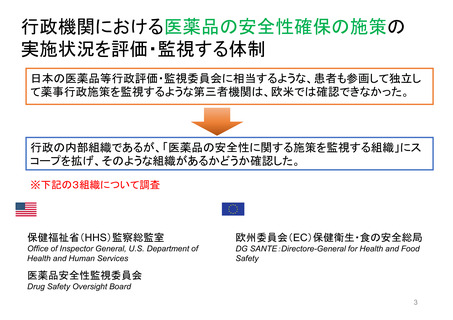
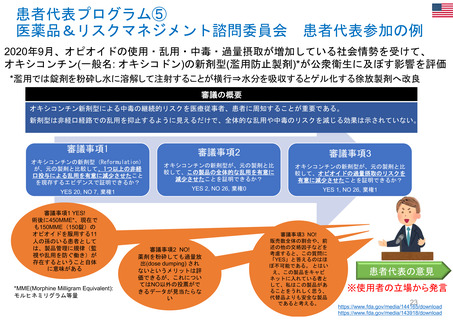
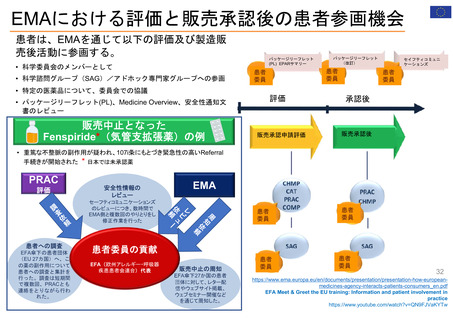
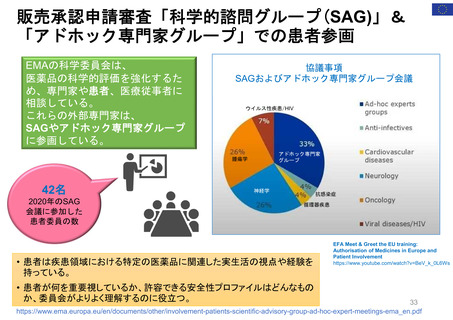
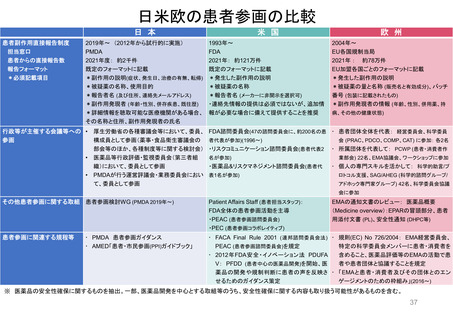
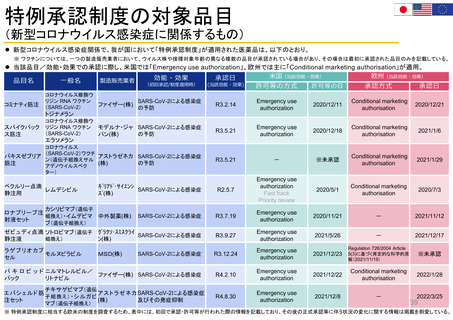
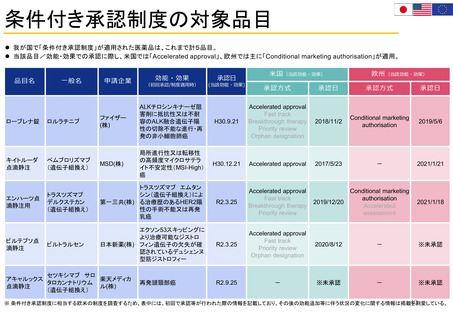
米国の患者・消費者からの副作用直接報告
• FDAにおける医薬品の副作用は、企業報告及びMedWatchを介して報告され、FAERS(FDA Adverse Events
Reporting System)に収載される。
• MedWatchには患者・消費者、医療従事者、ヘルスケア等から、ウェブサイト及び紙面(郵送)を介して報告が
行われる。
• 患者からの副作用直接報告は1993年に開始された。
• 症例の評価は、製薬企業や医療従事者からの報告と併せて、個別症例レベルでの日常的な評価を行うほか、
FAERSに蓄積された症例を用いたスクリーニング評価を行っている。
個別症例について、消費者と企業から同じ症例が重複報告されることがあり、情報の質は報告によってバラツキがある
が、因果関係評価の上で、個別症例の報告の質が高いことが重要とされている。
蓄積された症例の評価は定期的に行われており、重篤な転帰、注目すべき有害事象、妊娠時や小児等特定の背景を
有する集団について評価している。
https://www.accessdata.fda.gov/scripts/medwatch/index.cfm?action=reporting.home
https://www.fda.gov/media/130216/download
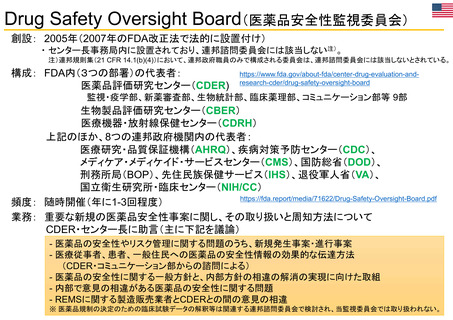
患者・消費者
医療従事者
*
2011 2012 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
承認薬
* 2022年は9月30日まで
2020 2021 2022
COVID-19 EUA
FAERS (FDA Adverse Events Reporting System) Public Dashboardより
https://fis.fda.gov/sense/app/95239e26-e0be-42d9-a960-9a5f7f1c25ee/sheet/7a47a261-d58b-4203-a8aa-6d3021737452/state/analysis
15
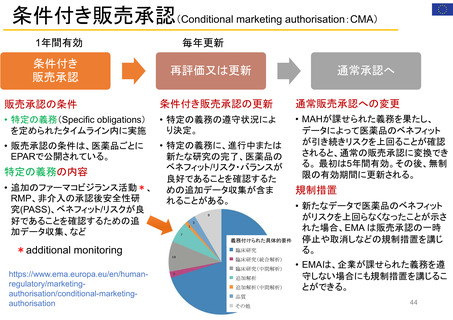
• FDAにおける医薬品の副作用は、企業報告及びMedWatchを介して報告され、FAERS(FDA Adverse Events
Reporting System)に収載される。
• MedWatchには患者・消費者、医療従事者、ヘルスケア等から、ウェブサイト及び紙面(郵送)を介して報告が
行われる。
• 患者からの副作用直接報告は1993年に開始された。
• 症例の評価は、製薬企業や医療従事者からの報告と併せて、個別症例レベルでの日常的な評価を行うほか、
FAERSに蓄積された症例を用いたスクリーニング評価を行っている。
個別症例について、消費者と企業から同じ症例が重複報告されることがあり、情報の質は報告によってバラツキがある
が、因果関係評価の上で、個別症例の報告の質が高いことが重要とされている。
蓄積された症例の評価は定期的に行われており、重篤な転帰、注目すべき有害事象、妊娠時や小児等特定の背景を
有する集団について評価している。
https://www.accessdata.fda.gov/scripts/medwatch/index.cfm?action=reporting.home
https://www.fda.gov/media/130216/download
患者・消費者
医療従事者
*
2011 2012 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
承認薬
* 2022年は9月30日まで
2020 2021 2022
COVID-19 EUA
FAERS (FDA Adverse Events Reporting System) Public Dashboardより
https://fis.fda.gov/sense/app/95239e26-e0be-42d9-a960-9a5f7f1c25ee/sheet/7a47a261-d58b-4203-a8aa-6d3021737452/state/analysis
15