よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
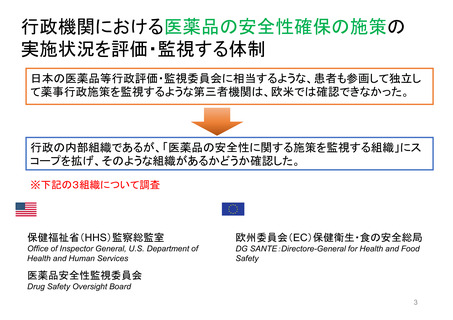
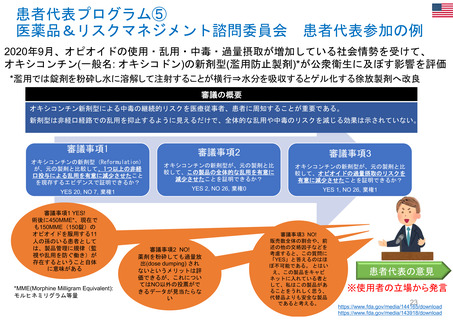
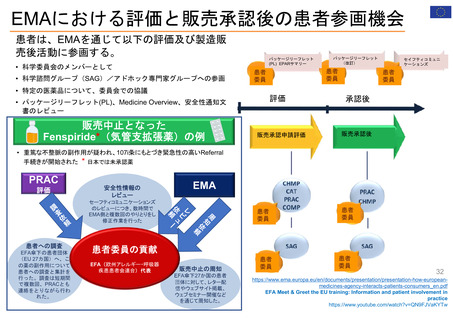
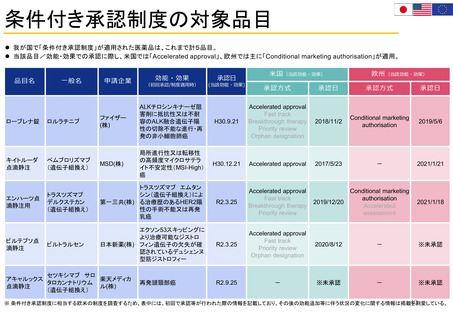
FDAにおける患者参画の歴史
エイズ
対策室
設立
患者連携
の契機
エイズ対策室は、エイズ・
特別健康問題担当室
(OASHI)に改称され、がん
患者やその他の重篤な疾患
患者を含むように拡大され
た。
FDAで初めて患者代表
Patient Representativeが
諮問委員会に参加
FDAとEMAで
Patient
Engagement
Clusterを設立
FDA長官室にPatient
Affairs Staff を配置
FDA患者代表プ
ログラムFDA
Patient
Representative
Program
科学・規制に関す
る審査担当者の相
談役(コンサルタ
ント)として役割
拡大
患者や消費者に、
FDAの既存の
MedWatchシス
テムを利用して、
医薬品の問題を
報告するよう奨
励
全米希少疾患患者協議会(NORD)との了解覚書により、患
者リスニングセッションのパイロットプログラムを開始
Clinical Trials Transformation Initiative (CTTI)と共同で
Patient Engagement Collaborative (PEC)を立ち上げ
PFDDガイダンスに関する
公開ワークショップ
第1回患者評議
会(局内)開催
FDA患者代表
FDA Patient
Representative
が諮問委員会で
の投票権を獲得
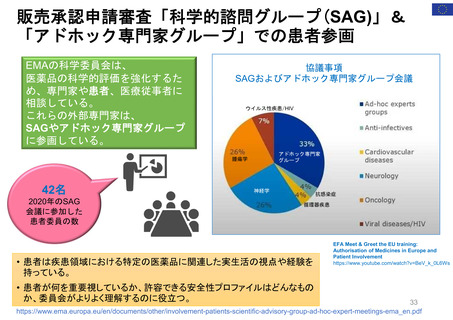
医療機器に関する患者参画
諮問委員会Patient
Engagement Advisory
Committee(PEAC)を設置
医療機器・放射線保健センター(CDRH)の患者・介護者コ
ネクション(P&CC)プログラム開始
PFDDガイダンスおよびドラフトに関する公開ワークショッ
プの開催
FDAのウェブサイ
トにFor Patients
(患者向け)
ページを作成
FDAのプロセスへの患者
の関与を高める方法を内
部ワーキンググループが
検討
患者中心の医薬品
開発 PatientFocused Drug
Development
(PFDD)の取組み
開始(FDASIA法)
FDAのMedWatchシステ
ムに、医薬品の問題を報
告するための消費者向け
フォームを導入
ペーシェントア
フェアーズ室
Staff(PAS)オン
ラインウェブ
フォーム、
Patients Ask FDA
PFDD ガイダンス
4に関する公開
ワークショップ
COVID-19患者リソースページ
開設
PFDDガイダンス1 最終版公開
患者プレファレンス
情報 Patient
Preference
Information (PPI)
医療機器の意思決定
のためのフレーム
ワークとガイダンス
医療機器に関する患
者参画諮問委員会
(PEAC)が連邦官報
に掲載される
Patient Affairs
Staffから
Patient Affairs室
に変更
COVID-19について筋ジストロ
フィー協会ウェビナー
希少疾患コミュニティにおける
COVID-19の影響についてFDA
とNORDリスニングセッション
PFDDガイダンス
2公開
17
エイズ
対策室
設立
患者連携
の契機
エイズ対策室は、エイズ・
特別健康問題担当室
(OASHI)に改称され、がん
患者やその他の重篤な疾患
患者を含むように拡大され
た。
FDAで初めて患者代表
Patient Representativeが
諮問委員会に参加
FDAとEMAで
Patient
Engagement
Clusterを設立
FDA長官室にPatient
Affairs Staff を配置
FDA患者代表プ
ログラムFDA
Patient
Representative
Program
科学・規制に関す
る審査担当者の相
談役(コンサルタ
ント)として役割
拡大
患者や消費者に、
FDAの既存の
MedWatchシス
テムを利用して、
医薬品の問題を
報告するよう奨
励
全米希少疾患患者協議会(NORD)との了解覚書により、患
者リスニングセッションのパイロットプログラムを開始
Clinical Trials Transformation Initiative (CTTI)と共同で
Patient Engagement Collaborative (PEC)を立ち上げ
PFDDガイダンスに関する
公開ワークショップ
第1回患者評議
会(局内)開催
FDA患者代表
FDA Patient
Representative
が諮問委員会で
の投票権を獲得
医療機器に関する患者参画
諮問委員会Patient
Engagement Advisory
Committee(PEAC)を設置
医療機器・放射線保健センター(CDRH)の患者・介護者コ
ネクション(P&CC)プログラム開始
PFDDガイダンスおよびドラフトに関する公開ワークショッ
プの開催
FDAのウェブサイ
トにFor Patients
(患者向け)
ページを作成
FDAのプロセスへの患者
の関与を高める方法を内
部ワーキンググループが
検討
患者中心の医薬品
開発 PatientFocused Drug
Development
(PFDD)の取組み
開始(FDASIA法)
FDAのMedWatchシステ
ムに、医薬品の問題を報
告するための消費者向け
フォームを導入
ペーシェントア
フェアーズ室
Staff(PAS)オン
ラインウェブ
フォーム、
Patients Ask FDA
PFDD ガイダンス
4に関する公開
ワークショップ
COVID-19患者リソースページ
開設
PFDDガイダンス1 最終版公開
患者プレファレンス
情報 Patient
Preference
Information (PPI)
医療機器の意思決定
のためのフレーム
ワークとガイダンス
医療機器に関する患
者参画諮問委員会
(PEAC)が連邦官報
に掲載される
Patient Affairs
Staffから
Patient Affairs室
に変更
COVID-19について筋ジストロ
フィー協会ウェビナー
希少疾患コミュニティにおける
COVID-19の影響についてFDA
とNORDリスニングセッション
PFDDガイダンス
2公開
17