よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
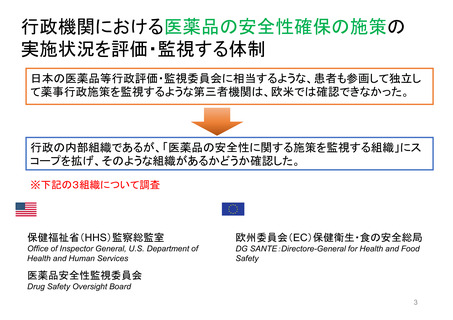
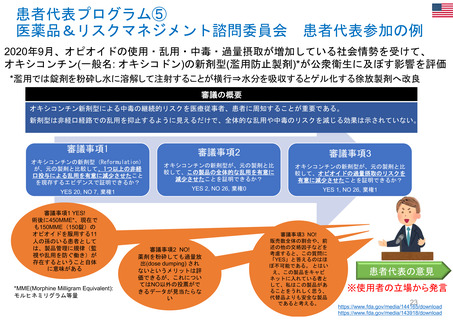
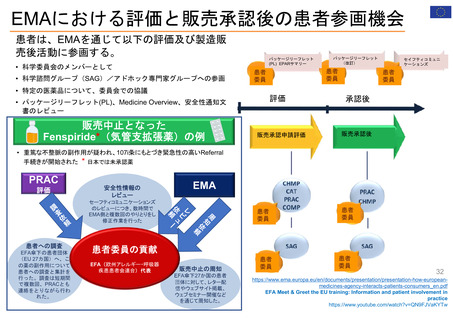
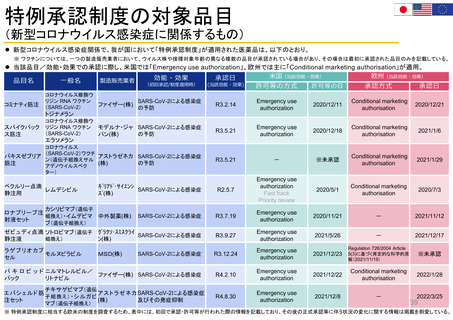
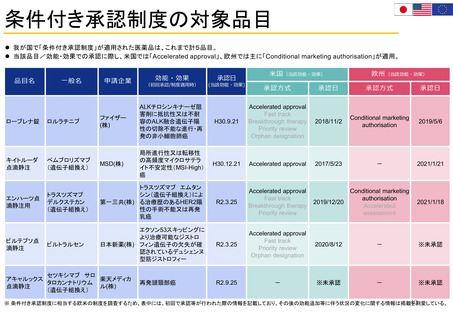
特例承認制度の対象品目
(新型コロナウイルス感染症に関係するもの)
新型コロナウイルス感染症関係で、我が国において「特例承認制度」が適用された医薬品は、以下のとおり。
※ ワクチンについては、一つの製造販売業者において、ウイルス株や接種対象年齢の異なる複数の品目が承認されている場合があり、その場合は最初に承認された品目のみを記載している。
当該品目/効能・効果での承認に際し、米国では「Emergency use authorization」、欧州では主に「Conditional marketing authorisation」が適用。
米国(当該効能・効果)
欧州(当該効能・効果)
効能・効果
承認日
製造販売業者
品目名
一般名
(初回承認/制度適用時)
(当該効能・効果)
許可等の日
許可等の方式
承認方式
承認日
コロナウイルス修飾ウ
リジン RNA ワクチン
SARS-CoV-2による感染症
ファイザー(株)
(SARS-CoV-2)
の予防
R3.2.14
Emergency use
authorization
2020/12/11
Conditional marketing
authorisation
2020/12/21
モデルナ・ジャ SARS-CoV-2による感染症
の予防
パン(株)
R3.5.21
Emergency use
authorization
2020/12/18
Conditional marketing
authorisation
2021/1/6
コロナウイルス
(SARS-CoV-2)ワクチ
バキスゼブリア
アストラゼネカ SARS-CoV-2による感染症
ン(遺伝子組換えサル
の予防
(株)
筋注
アデノウイルスベク
ター)
R3.5.21
-
※未承認
Conditional marketing
authorisation
2021/1/29
R2.5.7
Emergency use
authorization
Fast track
Priority review
2020/5/1
Conditional marketing
authorisation
2020/7/3
SARS-CoV-2による感染症
R3.7.19
Emergency use
authorization
2020/11/21
-
2021/11/12
ゼビュディ点滴 ソトロビマブ(遺伝子 グラクソ・スミスクライ
SARS-CoV-2による感染症
組換え)
静注液
ン(株)
R3.9.27
Emergency use
authorization
2021/5/26
-
2021/12/17
ラゲブリオカプ
モルヌピラビル
セル
SARS-CoV-2による感染症
R3.12.24
Emergency use
authorization
2021/12/23
Regulation 726/2004 Article
5(3)に基づく肯定的な科学的見
解(2021/11/19)
※未承認
パ キ ロ ビ ッ ド ニルマトレルビル/
ファイザー(株) SARS-CoV-2による感染症
パック
リトナビル
R4.2.10
Emergency use
authorization
2021/12/22
Conditional marketing
authorisation
2022/1/28
チキサゲビマブ(遺伝
エバシェルド筋
ア ス ト ラ ゼ ネ カ SARS-CoV-2による感染症
子組換え) ・シルガビ
(株)
注セット
及びその発症抑制
マブ(遺伝子組換え)
R4.8.30
Emergency use
authorization
2021/12/8
-
コミナティ筋注
トジナメラン
コロナウイルス修飾ウ
スパイクバック リジン RNA ワクチン
(SARS-CoV-2)
ス筋注
エラソメラン
ベクルリー点滴
レムデシビル
静注用
ギリアド・サイエンシ
SARS-CoV-2による感染症
ズ(株)
カシリビマブ(遺伝子
ロナプリーブ注
組換え)・イムデビマ 中外製薬(株)
射液セット
ブ(遺伝子組換え)
MSD(株)
2022/3/25
39
※ 特例承認制度に相当する欧米の制度を調査するため、表中には、初回で承認・許可等が行われた際の情報を記載しており、その後の正式承認等に伴う状況の変化に関する情報は掲載を割愛している。
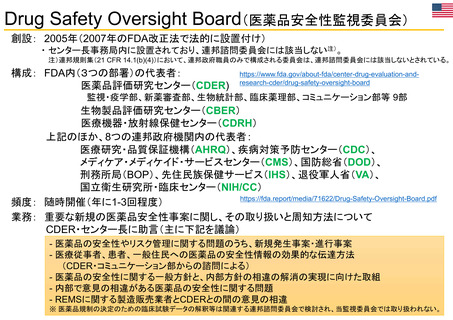
(新型コロナウイルス感染症に関係するもの)
新型コロナウイルス感染症関係で、我が国において「特例承認制度」が適用された医薬品は、以下のとおり。
※ ワクチンについては、一つの製造販売業者において、ウイルス株や接種対象年齢の異なる複数の品目が承認されている場合があり、その場合は最初に承認された品目のみを記載している。
当該品目/効能・効果での承認に際し、米国では「Emergency use authorization」、欧州では主に「Conditional marketing authorisation」が適用。
米国(当該効能・効果)
欧州(当該効能・効果)
効能・効果
承認日
製造販売業者
品目名
一般名
(初回承認/制度適用時)
(当該効能・効果)
許可等の日
許可等の方式
承認方式
承認日
コロナウイルス修飾ウ
リジン RNA ワクチン
SARS-CoV-2による感染症
ファイザー(株)
(SARS-CoV-2)
の予防
R3.2.14
Emergency use
authorization
2020/12/11
Conditional marketing
authorisation
2020/12/21
モデルナ・ジャ SARS-CoV-2による感染症
の予防
パン(株)
R3.5.21
Emergency use
authorization
2020/12/18
Conditional marketing
authorisation
2021/1/6
コロナウイルス
(SARS-CoV-2)ワクチ
バキスゼブリア
アストラゼネカ SARS-CoV-2による感染症
ン(遺伝子組換えサル
の予防
(株)
筋注
アデノウイルスベク
ター)
R3.5.21
-
※未承認
Conditional marketing
authorisation
2021/1/29
R2.5.7
Emergency use
authorization
Fast track
Priority review
2020/5/1
Conditional marketing
authorisation
2020/7/3
SARS-CoV-2による感染症
R3.7.19
Emergency use
authorization
2020/11/21
-
2021/11/12
ゼビュディ点滴 ソトロビマブ(遺伝子 グラクソ・スミスクライ
SARS-CoV-2による感染症
組換え)
静注液
ン(株)
R3.9.27
Emergency use
authorization
2021/5/26
-
2021/12/17
ラゲブリオカプ
モルヌピラビル
セル
SARS-CoV-2による感染症
R3.12.24
Emergency use
authorization
2021/12/23
Regulation 726/2004 Article
5(3)に基づく肯定的な科学的見
解(2021/11/19)
※未承認
パ キ ロ ビ ッ ド ニルマトレルビル/
ファイザー(株) SARS-CoV-2による感染症
パック
リトナビル
R4.2.10
Emergency use
authorization
2021/12/22
Conditional marketing
authorisation
2022/1/28
チキサゲビマブ(遺伝
エバシェルド筋
ア ス ト ラ ゼ ネ カ SARS-CoV-2による感染症
子組換え) ・シルガビ
(株)
注セット
及びその発症抑制
マブ(遺伝子組換え)
R4.8.30
Emergency use
authorization
2021/12/8
-
コミナティ筋注
トジナメラン
コロナウイルス修飾ウ
スパイクバック リジン RNA ワクチン
(SARS-CoV-2)
ス筋注
エラソメラン
ベクルリー点滴
レムデシビル
静注用
ギリアド・サイエンシ
SARS-CoV-2による感染症
ズ(株)
カシリビマブ(遺伝子
ロナプリーブ注
組換え)・イムデビマ 中外製薬(株)
射液セット
ブ(遺伝子組換え)
MSD(株)
2022/3/25
39
※ 特例承認制度に相当する欧米の制度を調査するため、表中には、初回で承認・許可等が行われた際の情報を記載しており、その後の正式承認等に伴う状況の変化に関する情報は掲載を割愛している。