よむ、つかう、まなぶ。
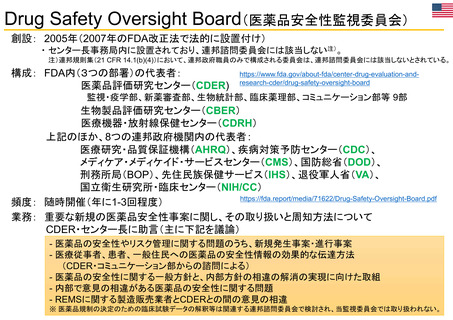
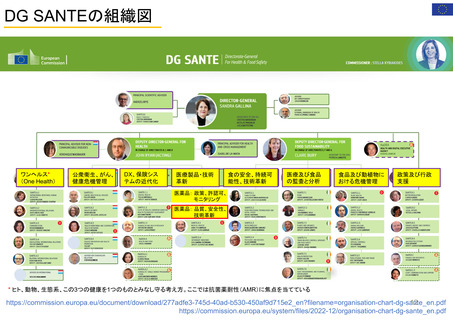
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
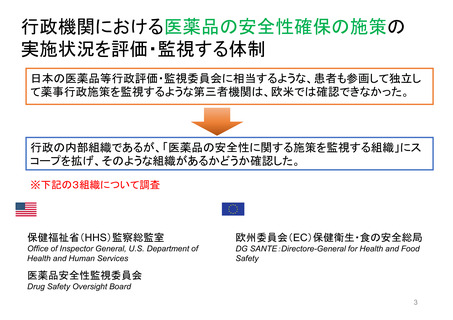
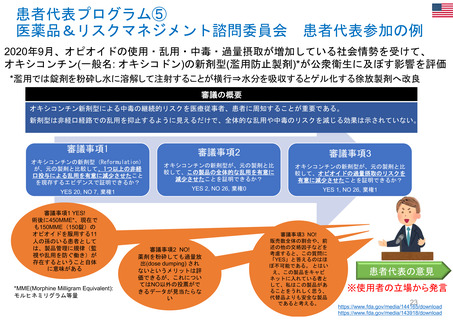
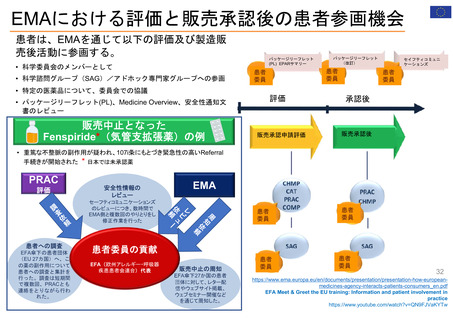
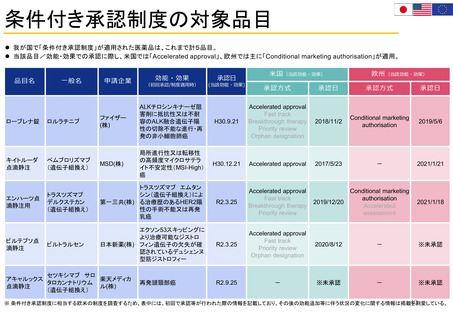
欧州の患者・消費者からの副作用直接報告
• 欧州における医薬品の副作用報告は、EudraVigilanceデータベースに収載される。
• 患者・消費者からの副作用直接報告は、英国において、 Yellow Card副作用報告システムの一部
として2005年から試行が開始され、2008年から正式に運営された。
• 欧州の患者・消費者は、各国の医薬品規制当局のオンライン患者報告フォームや電話、郵送など
を通じ、副作用疑い例を直接報告することができる。
• 患者報告は因果関係不明でも報告対象とされ、データベースに収載される。
• 本制度により、欧州市民からリスクに関するシグナルを迅速に受け取り、重要な安全性情報をより
早く伝えることができる。
• 報告された症例は、重複した報告の削除、医薬品名と有効成分の紐付け等が行われ、
EudraVigilanceデータベースに収載された後に定期的な安全性シグナルの評価に活用されている。
https://www.ema.europa.eu/en/documents/report/2021-annual-report-eudravigilanceeuropean-parliament-council-commission_en.pdf
https://www.adrreports.eu/docs/ADR_reporting_FINAL_EN.pdf
https://www.adrreports.eu/en/report_side_effect.html
• 2021年に、欧州の患者・消費者から提出された副作用
報告数は前年の5倍であった。
• これは、数億人規模の欧州市民に対してCOVID-19ワク
チン接種が行われたこと、医薬品の副作用をすべて規
制機関に報告するよう奨励されてきたことが反映された
結果である。
欧州の患者・消費者からの副作用直接報告
(EMAのAnnual Reportより)
https://www.ema.europa.eu/en/documents/annual-report/2021-annual16
report-european-medicines-agency_en.pdf
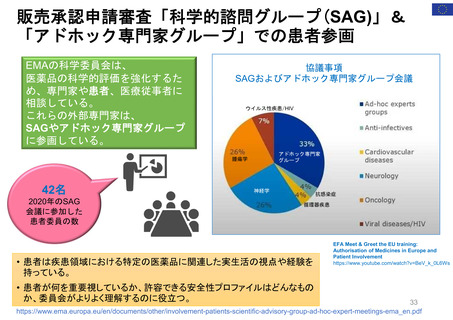
• 欧州における医薬品の副作用報告は、EudraVigilanceデータベースに収載される。
• 患者・消費者からの副作用直接報告は、英国において、 Yellow Card副作用報告システムの一部
として2005年から試行が開始され、2008年から正式に運営された。
• 欧州の患者・消費者は、各国の医薬品規制当局のオンライン患者報告フォームや電話、郵送など
を通じ、副作用疑い例を直接報告することができる。
• 患者報告は因果関係不明でも報告対象とされ、データベースに収載される。
• 本制度により、欧州市民からリスクに関するシグナルを迅速に受け取り、重要な安全性情報をより
早く伝えることができる。
• 報告された症例は、重複した報告の削除、医薬品名と有効成分の紐付け等が行われ、
EudraVigilanceデータベースに収載された後に定期的な安全性シグナルの評価に活用されている。
https://www.ema.europa.eu/en/documents/report/2021-annual-report-eudravigilanceeuropean-parliament-council-commission_en.pdf
https://www.adrreports.eu/docs/ADR_reporting_FINAL_EN.pdf
https://www.adrreports.eu/en/report_side_effect.html
• 2021年に、欧州の患者・消費者から提出された副作用
報告数は前年の5倍であった。
• これは、数億人規模の欧州市民に対してCOVID-19ワク
チン接種が行われたこと、医薬品の副作用をすべて規
制機関に報告するよう奨励されてきたことが反映された
結果である。
欧州の患者・消費者からの副作用直接報告
(EMAのAnnual Reportより)
https://www.ema.europa.eu/en/documents/annual-report/2021-annual16
report-european-medicines-agency_en.pdf