よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
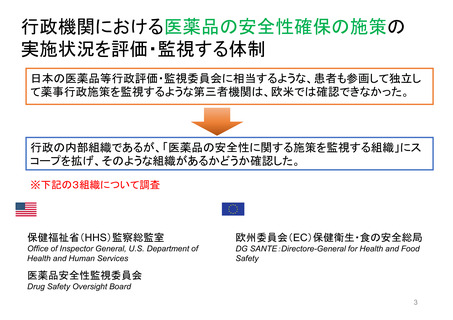
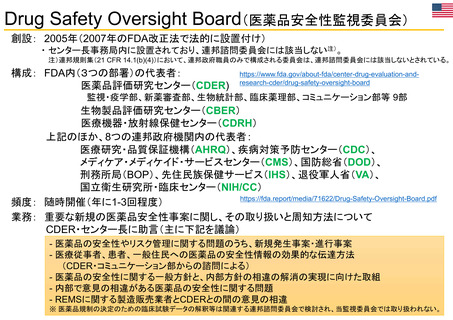
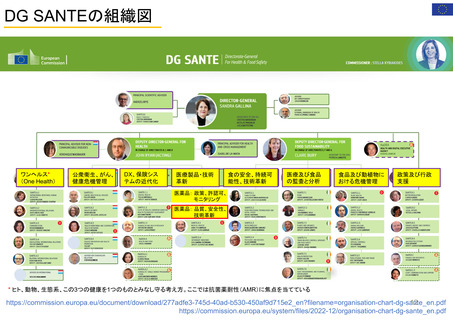
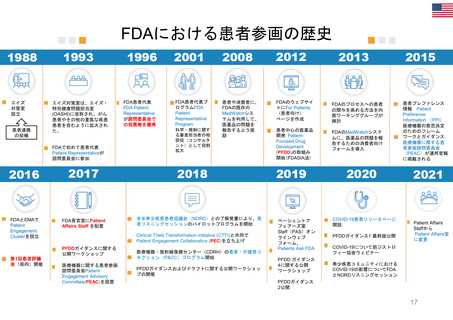
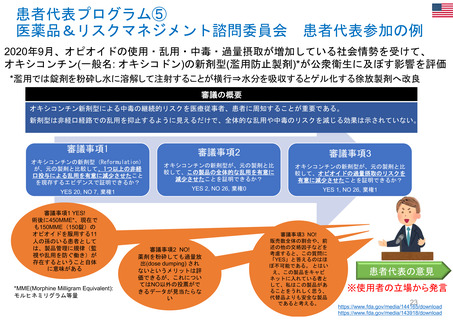
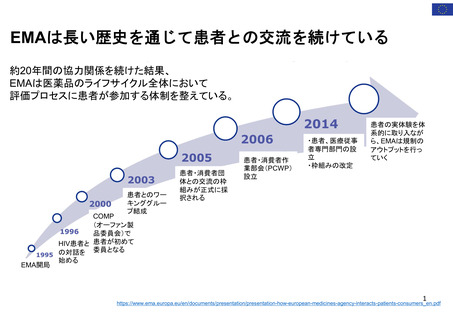
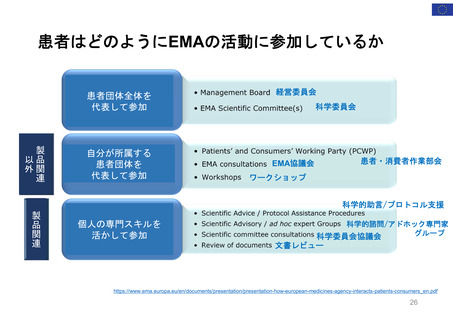
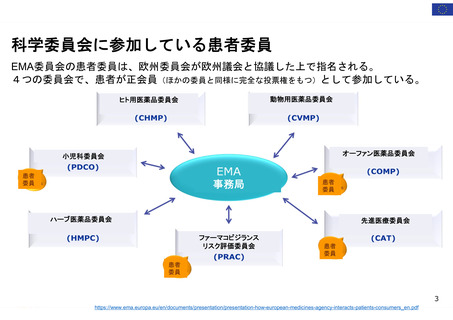
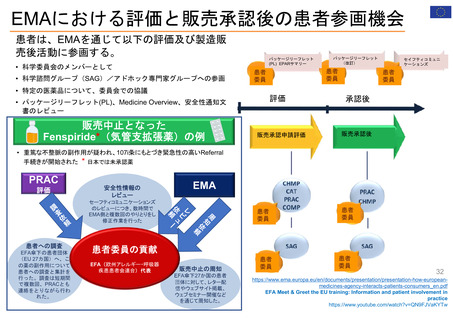
OIGレポートの例①-2
FDAには、REMS (リスク評価・軽減対策)が医薬品安全性を向上させて
いるか判断するための包括的なデータが不足している
【Report OEI-04-11-00510 (February 2013)】
◇OIGからFDAへの勧告の内容
今回の結果は、REMSプログラムの全般的な効果について懸念を引き起こすものであった。これらの
懸念に対処するため、 FDAによるREMS評価(evaluation and assessment) およびスポンサーによ
るREMS評価についてFDAが実施したレビューに関し、 OIGは7つの勧告を行った 。
1. REMSの構成要素を特定、開発、検証、評価するための計画を立案し、実施すること
2. 目標を達成していないREMSを特定し、公衆衛生を守るため、適切な措置を講じること
3. 連邦法に要求されているように、毎年1件のREMSのETASUを評価すること
4. 不完全なスポンサー評価を特定し、不足情報の入手にスポンサーと共同で取り組むこと
5. FDA評価計画において、スポンサー評価に期待する内容を明確化すること
6. FDA評価計画に強制力をもたせるよう、法的権限を要求すること
7. 評価が適切な時期にレビューされることを確実にすること
(出所) https://oig.hhs.gov/oei/reports/oei-04-11-00510.pdf
※2022 年12月に発行されたHHS-OIG Fact Sheetの中で、未だ実施されていない勧告の主な例として挙げられている。
8
(出所) https://oig.hhs.gov/reports-and-publications/compendium/files/compendium2022.pdf#page=35
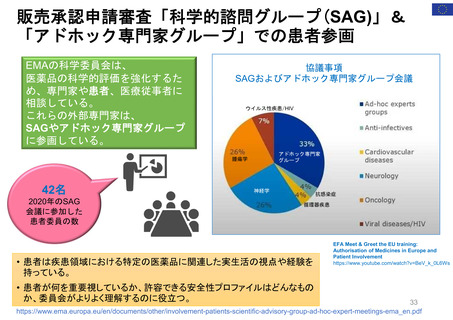
FDAには、REMS (リスク評価・軽減対策)が医薬品安全性を向上させて
いるか判断するための包括的なデータが不足している
【Report OEI-04-11-00510 (February 2013)】
◇OIGからFDAへの勧告の内容
今回の結果は、REMSプログラムの全般的な効果について懸念を引き起こすものであった。これらの
懸念に対処するため、 FDAによるREMS評価(evaluation and assessment) およびスポンサーによ
るREMS評価についてFDAが実施したレビューに関し、 OIGは7つの勧告を行った 。
1. REMSの構成要素を特定、開発、検証、評価するための計画を立案し、実施すること
2. 目標を達成していないREMSを特定し、公衆衛生を守るため、適切な措置を講じること
3. 連邦法に要求されているように、毎年1件のREMSのETASUを評価すること
4. 不完全なスポンサー評価を特定し、不足情報の入手にスポンサーと共同で取り組むこと
5. FDA評価計画において、スポンサー評価に期待する内容を明確化すること
6. FDA評価計画に強制力をもたせるよう、法的権限を要求すること
7. 評価が適切な時期にレビューされることを確実にすること
(出所) https://oig.hhs.gov/oei/reports/oei-04-11-00510.pdf
※2022 年12月に発行されたHHS-OIG Fact Sheetの中で、未だ実施されていない勧告の主な例として挙げられている。
8
(出所) https://oig.hhs.gov/reports-and-publications/compendium/files/compendium2022.pdf#page=35