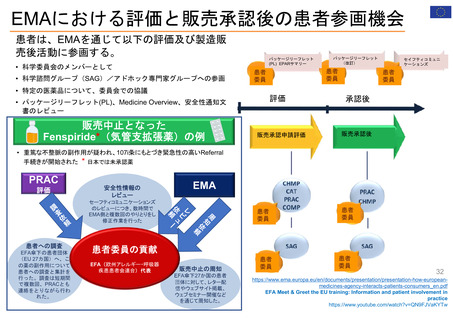
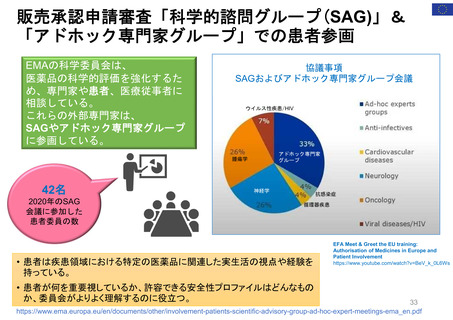
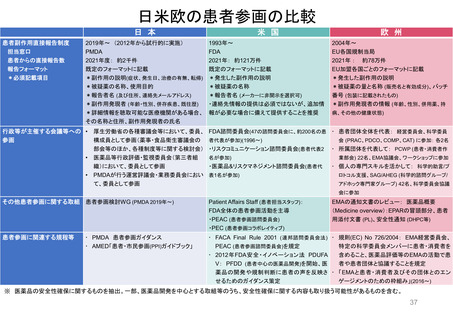
よむ、つかう、まなぶ。
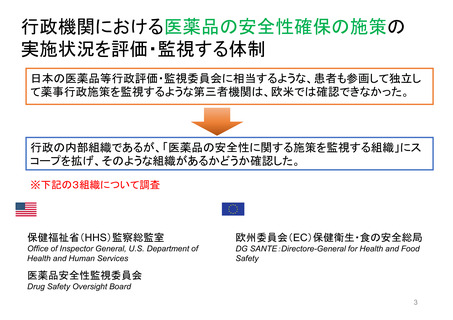
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (43 ページ)
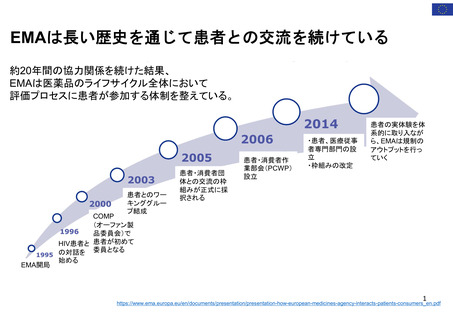
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
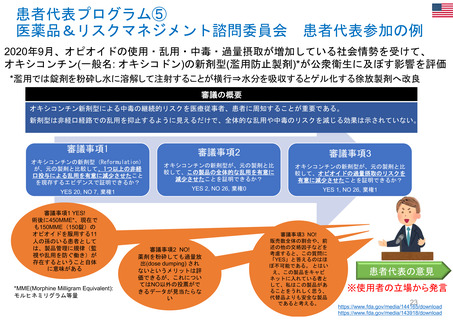
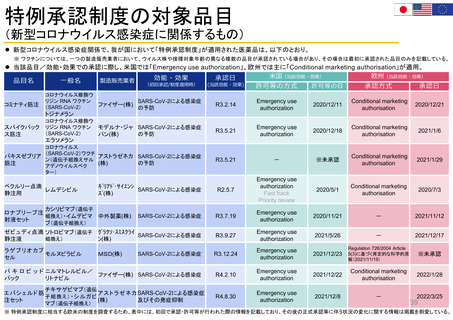
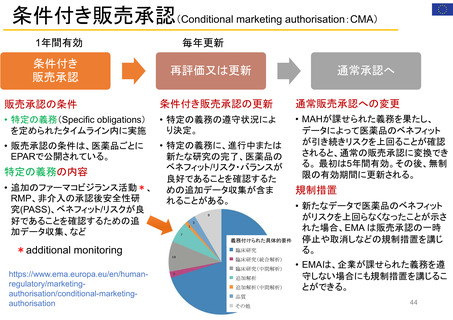
迅速承認(Accelerated approval)
• 新薬が患者に真の改善(生存期間延長や臨床的改善)をもたらすかを確認するには長い年月を要することから、
真のエンドポイントに代わる代替エンドポイントにもとづき、医学的ニーズを満たす重篤疾患治療薬を速やかに
承認する accelerated approval 制度を 1992 年にFDAが制定。FD&C法の第506条(c)に迅速承認条項(提案
された代替エンドポイントが臨床的ベネフィットを予測する合理的可能性があること)が示されている。
代替エンドポイントとは、臨床検査値や身体的徴候などの指標であり、臨床試験において生存率や症状改善
などの臨床アウトカムの代わりとなるものである。代替エン ドポイントの利用により、FDA から承認を受ける
までの期間をかなり短縮させることができる。
代替エンドポイントにもとづく医薬品承認は,市販後臨床試験で臨床ベネフィット を検証することを条件に与
えられる。確認試験で実際に臨床ベネフィットをもたらすことが示された場合、通常承認が与えられるが、臨床
ベネフィットが示されなかった場合、承認が取り消される。
FDAは、これまでに医薬品の承認の根拠となった代替エンドポイントの一覧表を公開している。
https://www.fda.gov/drugs/development-resources/table-surrogate-endpoints-were-basis-drug-approval-or-licensure
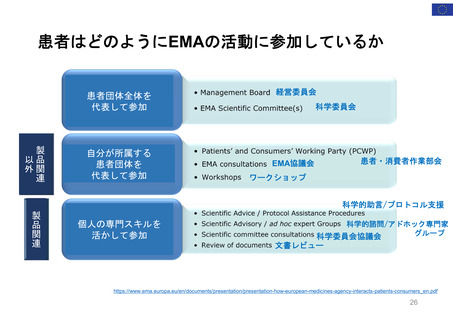
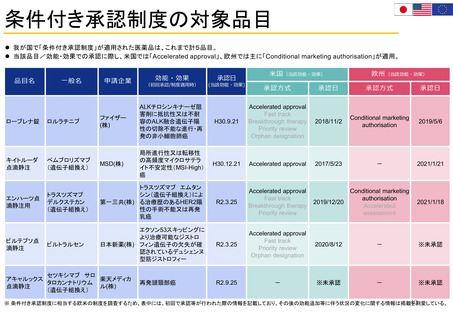
代替エンドポイント
客観的奏効率
(ORR: objective response rate)
公開審査報告書
品目名
一般名
ローブレナ錠
ロルラチニブ
キイトルーダ点滴静注
ペムブロリズマブ(遺伝子組換え) ORR
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2014/125514Orig1s000TOC.cfm
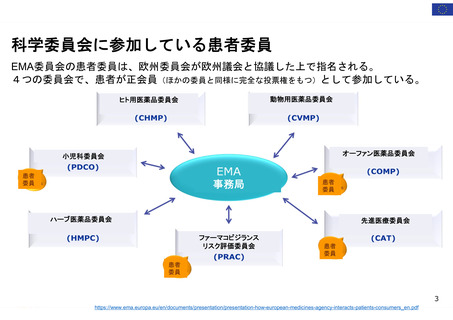
エンハーツ点滴静注用
トラスツズマブ デルクステカン 客観的奏効率及び奏効期間
(遺伝子組換え)
(ORR and DoR: duration of response)
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2019/761139Orig1s000AdminCorres.pdf
ビルテプソ点滴静注
ビルトラルセン
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2020/212154Orig1s000AdminCorres.pdf
ジストロフィンの増加
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2018/210868Orig1s000Admincorres.pdf
注)
• 上記4品目について、承認条件 の中で、適用する患者に関する情報を収集する趣旨のものは確認できたが、
特別な安全性情報収集を明確に求めているものは確認できなかった。
注) FD&C法第506条(c)の迅速承認条項に従って承認された医薬品について予測した効果その他臨床的有用性を検証するため、FDAは、申請者に
市販後研究/試験の実施を要求することができるとされている。 https://www.fda.gov/media/165114/download?utm_medium=email&utm_source=govdelivery
43
• 新薬が患者に真の改善(生存期間延長や臨床的改善)をもたらすかを確認するには長い年月を要することから、
真のエンドポイントに代わる代替エンドポイントにもとづき、医学的ニーズを満たす重篤疾患治療薬を速やかに
承認する accelerated approval 制度を 1992 年にFDAが制定。FD&C法の第506条(c)に迅速承認条項(提案
された代替エンドポイントが臨床的ベネフィットを予測する合理的可能性があること)が示されている。
代替エンドポイントとは、臨床検査値や身体的徴候などの指標であり、臨床試験において生存率や症状改善
などの臨床アウトカムの代わりとなるものである。代替エン ドポイントの利用により、FDA から承認を受ける
までの期間をかなり短縮させることができる。
代替エンドポイントにもとづく医薬品承認は,市販後臨床試験で臨床ベネフィット を検証することを条件に与
えられる。確認試験で実際に臨床ベネフィットをもたらすことが示された場合、通常承認が与えられるが、臨床
ベネフィットが示されなかった場合、承認が取り消される。
FDAは、これまでに医薬品の承認の根拠となった代替エンドポイントの一覧表を公開している。
https://www.fda.gov/drugs/development-resources/table-surrogate-endpoints-were-basis-drug-approval-or-licensure
代替エンドポイント
客観的奏効率
(ORR: objective response rate)
公開審査報告書
品目名
一般名
ローブレナ錠
ロルラチニブ
キイトルーダ点滴静注
ペムブロリズマブ(遺伝子組換え) ORR
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2014/125514Orig1s000TOC.cfm
エンハーツ点滴静注用
トラスツズマブ デルクステカン 客観的奏効率及び奏効期間
(遺伝子組換え)
(ORR and DoR: duration of response)
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2019/761139Orig1s000AdminCorres.pdf
ビルテプソ点滴静注
ビルトラルセン
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2020/212154Orig1s000AdminCorres.pdf
ジストロフィンの増加
https://www.accessdata.fda.gov/drugsatfda_doc
s/nda/2018/210868Orig1s000Admincorres.pdf
注)
• 上記4品目について、承認条件 の中で、適用する患者に関する情報を収集する趣旨のものは確認できたが、
特別な安全性情報収集を明確に求めているものは確認できなかった。
注) FD&C法第506条(c)の迅速承認条項に従って承認された医薬品について予測した効果その他臨床的有用性を検証するため、FDAは、申請者に
市販後研究/試験の実施を要求することができるとされている。 https://www.fda.gov/media/165114/download?utm_medium=email&utm_source=govdelivery
43