よむ、つかう、まなぶ。
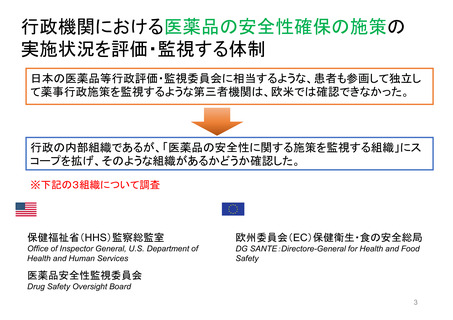
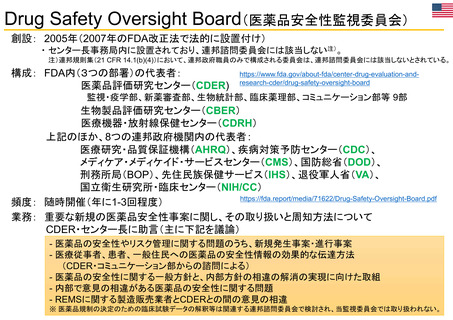
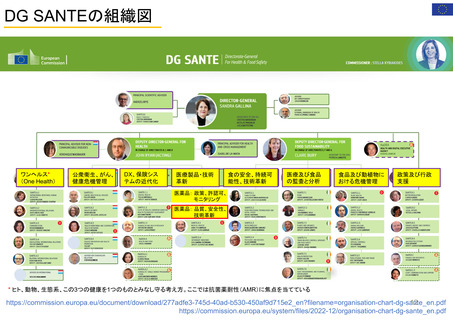
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
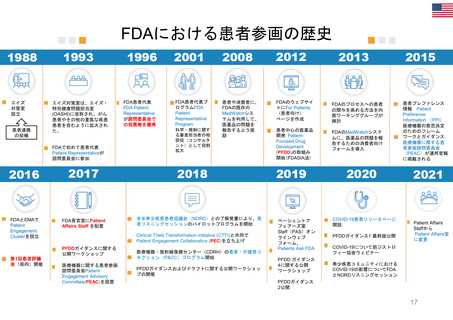
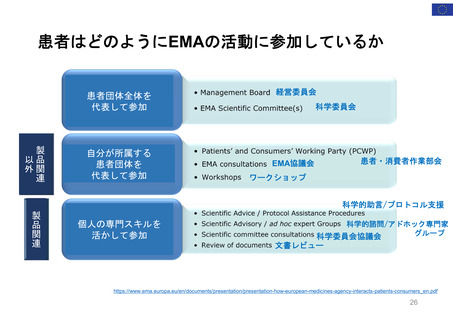
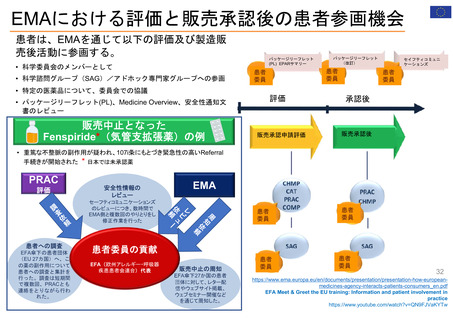
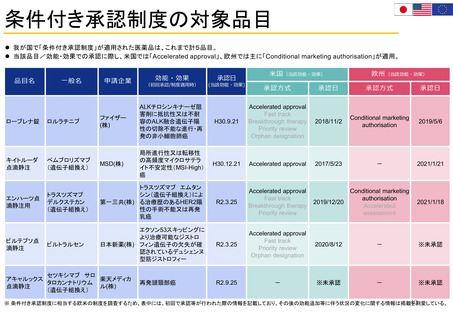
医薬品のライフサイクルにおける患者委員参加の機会
医薬品開発段階、承認審査、市販後の全過程で患者の声をEMAの活動に取り入れることが可能
公的文書
オーファンドラッ
グ指定に関する
見解の要約
患者
委員
患者
委員
承認申請前
規制手続き
オーファン指定
申請ATMP分類
委員会とワーキングパーティ
患者
委員
科学的助言
プロトコル支援
患者
委員
患者
委員
小児調査計画
患者
委員
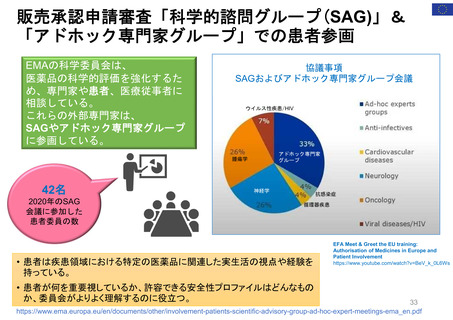
販売承認申請審査
患者
委員
患者
委員
患者
委員
患者
委員
評価
セイフティ
コミュニケーションズ
パッケージリーフレット
EPARサマリー(改訂)
パッケージリーフレット
EPARサマリー
承認後
市販後リスク評価
患者
委員
患者
委員
https://www.ema.europa.eu/en/documents/presentation/presentation-how-european-medicines-agency-interacts-patients-consumers_en.pdf 31
医薬品開発段階、承認審査、市販後の全過程で患者の声をEMAの活動に取り入れることが可能
公的文書
オーファンドラッ
グ指定に関する
見解の要約
患者
委員
患者
委員
承認申請前
規制手続き
オーファン指定
申請ATMP分類
委員会とワーキングパーティ
患者
委員
科学的助言
プロトコル支援
患者
委員
患者
委員
小児調査計画
患者
委員
販売承認申請審査
患者
委員
患者
委員
患者
委員
患者
委員
評価
セイフティ
コミュニケーションズ
パッケージリーフレット
EPARサマリー(改訂)
パッケージリーフレット
EPARサマリー
承認後
市販後リスク評価
患者
委員
患者
委員
https://www.ema.europa.eu/en/documents/presentation/presentation-how-european-medicines-agency-interacts-patients-consumers_en.pdf 31