よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
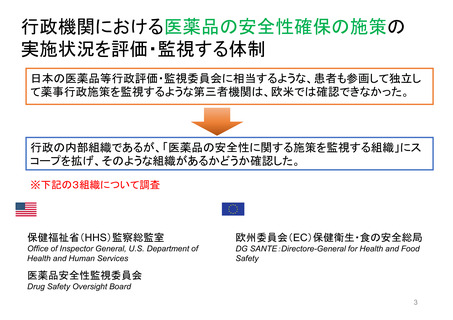
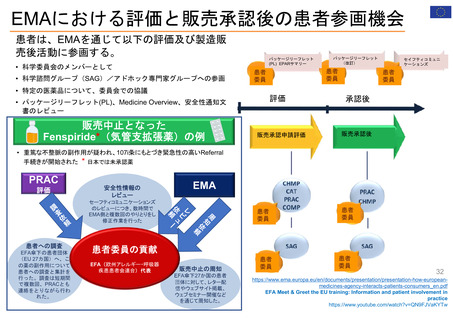
EMAのパブリック・コミュニケーションにおける
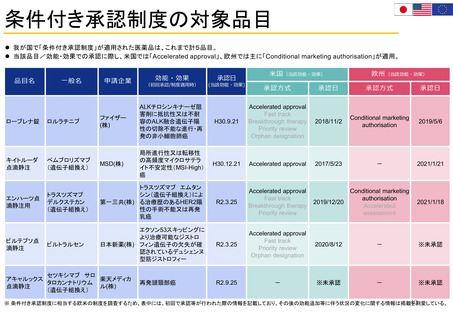
患者参加の概要
患者によるレビューが行われている通知文書
書類
医薬品概要
(Medicine overview)
*EMAウェブサイトに掲載
EPAR(European public assessment
report:公開医薬品審査報告書)の冒頭部分
セーフティー・コミュニケー
ションズ
(安全性情報
Safety communications)
内容
レビュー時間
患者が読んでわかりやすいように、説明に一般的な表現が
かっこ書きで補足されている。
例)abdominal wall(腹壁)→tummy (おなか)
deltoid region(三角筋部)→upper arm (上腕)
blood glucose (血糖)→sugar(口語的表現で血糖)
8~10日間
2022/11/3 EMA担当者 Dr. Maria Mavrisより
承認済み医薬品の使用に関する重要で新しいメッセージを伝える
ために用意されている文書
*EMA職員、専門家、医療従事者、製薬会社もレビューを
同時に行う
緊急性が高い
12~24時間
安全性に関する重要な連絡がある場合に
発行される
患者用情報
(PL: Package leaflet)
医薬品の製品箱に同梱される説明文書
https://www.ema.europa.eu/en/documents/presentation/presentation-overview-patient-involvement-ema-public-communications-mmavris-ema_en.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-review-documents_en.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-what-are-safety-communications-how-review-them-federica-castellani_en-0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
10日間
36
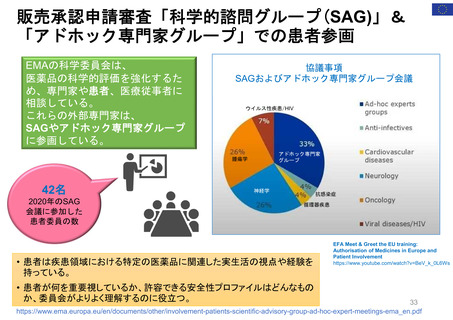
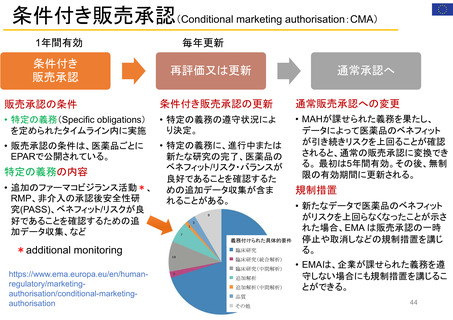
患者参加の概要
患者によるレビューが行われている通知文書
書類
医薬品概要
(Medicine overview)
*EMAウェブサイトに掲載
EPAR(European public assessment
report:公開医薬品審査報告書)の冒頭部分
セーフティー・コミュニケー
ションズ
(安全性情報
Safety communications)
内容
レビュー時間
患者が読んでわかりやすいように、説明に一般的な表現が
かっこ書きで補足されている。
例)abdominal wall(腹壁)→tummy (おなか)
deltoid region(三角筋部)→upper arm (上腕)
blood glucose (血糖)→sugar(口語的表現で血糖)
8~10日間
2022/11/3 EMA担当者 Dr. Maria Mavrisより
承認済み医薬品の使用に関する重要で新しいメッセージを伝える
ために用意されている文書
*EMA職員、専門家、医療従事者、製薬会社もレビューを
同時に行う
緊急性が高い
12~24時間
安全性に関する重要な連絡がある場合に
発行される
患者用情報
(PL: Package leaflet)
医薬品の製品箱に同梱される説明文書
https://www.ema.europa.eu/en/documents/presentation/presentation-overview-patient-involvement-ema-public-communications-mmavris-ema_en.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-how-patients-are-involved-review-documents_en.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-what-are-safety-communications-how-review-them-federica-castellani_en-0.pdf
https://www.ema.europa.eu/en/documents/presentation/presentation-what-package-leaflet-how-review-it-claire-espinasse_en-0.pdf
10日間
36