よむ、つかう、まなぶ。
別紙2○先進医療Bに係る新規技術の科学的評価等について (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00067.html |
| 出典情報 | 先進医療会議(第130回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
予測できない不具合とは、取扱説明書、添付文書及び本研究計画書に記載されていないもの、あるいは記
載されていてもその性質や度合いが記載内容と一致しないものをいう。
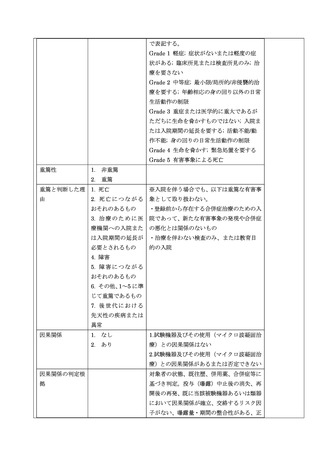
3)重篤な有害事象の定義
重篤な有害事象とは、有害事象のうち、次の 1 から 7 に該当するものとする。
1. 死亡
2. 死亡につながるおそれのあるもの
3. 治療のために医療機関への入院または入院期間の延長が必要とされるもの
4. 障害
5. 障害につながるおそれのあるもの
6. その他、1~5 に準じて重篤であるもの
7. 後世代における先天性の疾病または異常
※入院を伴う場合でも、以下は重篤な有害事象として取り扱わない。
・登録前から存在する合併症治療のための入院であって、新たな有害事象の発現や合併症の悪化とは関係
のないもの
・治療を伴わない検査のみ、または教育目的の入院
4)本試験で収集する有害事象の取り扱い
本試験で収集する有害事象の取り扱いは以下とする。
(1)重篤な有害事象は、因果関係に関わらず収集する。
(2)重篤な有害事象以外は、因果関係のある有害事象を収集する。
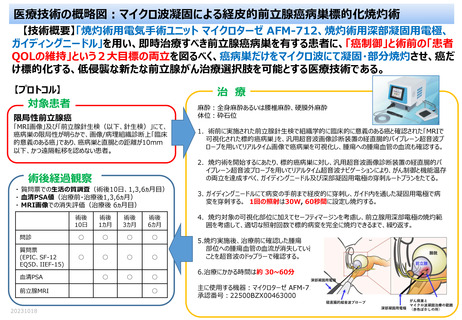
5)前立腺癌についての取り扱い
(1)治療部位以外の新たな前立腺癌の発現は有害事象とする。
(2)前立腺の治療部位が CISca 以下になっている場合は有害事象として取り扱わない。
CISca の診断については、MRI 画像と前立腺生検組織診断に基づく。
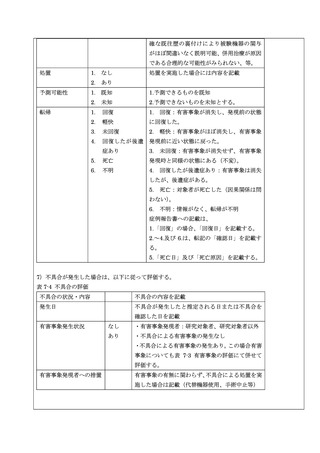
6)有害事象の評価
本試験では、試験治療開始から観察期間終了まで(手術後 6 か月または中止時まで)に発現した有害事象
を評価する。
有害事象は以下の標準化された用語に基づき、担当医師の診察・問診及び患者報告により評価する。診察・
問診は、入院中は毎日、その後、手術後の再診日(手術後 10 日、手術後 1 か月、手術後 3 か月、手術後
6 か月)に施行し、その予定された日程以外であっても、診療行為があった場合においても同様に報告・
評価する。本試験の有害事象の評価は、表 7-3 を参照すること。
7-1.有効性及び安全性の評価
7-1.1 主要評価項目
以下の 1)血清指標 かつ 2)画像指標 かつ 3)病理組織指標の達成
1) 手術後 3 か月または 6 か月における血清 PSA 値の手術前からの 50%以上の減少
31
載されていてもその性質や度合いが記載内容と一致しないものをいう。
3)重篤な有害事象の定義
重篤な有害事象とは、有害事象のうち、次の 1 から 7 に該当するものとする。
1. 死亡
2. 死亡につながるおそれのあるもの
3. 治療のために医療機関への入院または入院期間の延長が必要とされるもの
4. 障害
5. 障害につながるおそれのあるもの
6. その他、1~5 に準じて重篤であるもの
7. 後世代における先天性の疾病または異常
※入院を伴う場合でも、以下は重篤な有害事象として取り扱わない。
・登録前から存在する合併症治療のための入院であって、新たな有害事象の発現や合併症の悪化とは関係
のないもの
・治療を伴わない検査のみ、または教育目的の入院
4)本試験で収集する有害事象の取り扱い
本試験で収集する有害事象の取り扱いは以下とする。
(1)重篤な有害事象は、因果関係に関わらず収集する。
(2)重篤な有害事象以外は、因果関係のある有害事象を収集する。
5)前立腺癌についての取り扱い
(1)治療部位以外の新たな前立腺癌の発現は有害事象とする。
(2)前立腺の治療部位が CISca 以下になっている場合は有害事象として取り扱わない。
CISca の診断については、MRI 画像と前立腺生検組織診断に基づく。
6)有害事象の評価
本試験では、試験治療開始から観察期間終了まで(手術後 6 か月または中止時まで)に発現した有害事象
を評価する。
有害事象は以下の標準化された用語に基づき、担当医師の診察・問診及び患者報告により評価する。診察・
問診は、入院中は毎日、その後、手術後の再診日(手術後 10 日、手術後 1 か月、手術後 3 か月、手術後
6 か月)に施行し、その予定された日程以外であっても、診療行為があった場合においても同様に報告・
評価する。本試験の有害事象の評価は、表 7-3 を参照すること。
7-1.有効性及び安全性の評価
7-1.1 主要評価項目
以下の 1)血清指標 かつ 2)画像指標 かつ 3)病理組織指標の達成
1) 手術後 3 か月または 6 か月における血清 PSA 値の手術前からの 50%以上の減少
31