よむ、つかう、まなぶ。
別紙2○先進医療Bに係る新規技術の科学的評価等について (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00067.html |
| 出典情報 | 先進医療会議(第130回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
を認めない
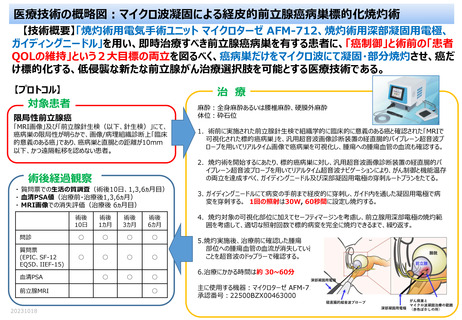
3-B: 手術後 6 か月の前立腺針生検による標的とした前立腺癌病巣の病理組織学的診断においてグリソ
ンスコア 6 以下
それぞれに 2 つずつの条件を設定するため、計 4 つの項目になる(表 7-2 参照)
。
表 7-2 副次評価項目 3)の組合せ
副次評価項目 3)
1.
2-A かつ 3-A の達成
2.
2-A かつ 3-B の達成
3.
2-B かつ 3-A の達成
4,
2-B かつ 3-B の達成
9) PRO(Patient Reported Outcomes)の経時的変化
4-1)EPIC(Expanded Prostate Cancer Index Composite)及び SF-12 の経時的変化(手術前、手術
後 10 日、手術後 1 か月、手術後 3 か月、手術後 6 か月)
4-2)IIEF-15(International Index of Erectile Function)の経時的変化(手術前、手術後 1 か月、手
術後 3 か月、手術後 6 か月)
4-3)EQ5D の経時的変化(手術前、手術後 6 か月)
10) 安全性評価
5-1)手術後 6 か月(または中止時)までの有害事象、不具合の発現と、有害事象の重症度
5-2)手術後 6 か月における尿失禁 (パッド・フリー達成の有無)
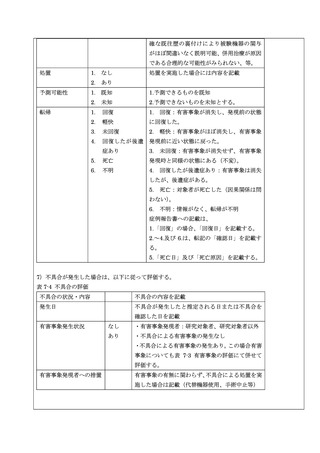
7-1.3 安全性を評価するために収集する有害事象
1)有害事象の定義
有害事象とは、試験治療が実施された対象者に生じたすべての疾病若しくは障害又はこれらの徴候、すな
わち、試験治療実施時に生じたすべての好ましくない又は意図しない疾病又は障害並びにその徴候(臨床
検査値の異常を含む。)をいい、試験治療との因果関係の有無は問わない。ただし、被験者以外の者に生じ
たものについては、試験機器の使用による影響と疑われるものに限る。試験治療開始前から存在した事象
(合併症)については、試験治療開始後に悪化したものを有害事象として取り扱う。
2)不具合の定義
不具合とは、試験機器の破損、作動不良等広く品質、安全性、性能等に関する試験機器の具合がよくない
ことをいう。設計、交付、保管、使用のいずれの段階によるものであるかを問わない。不具合による影響
かどうか不明である場合も、不具合による影響に含む。
予測できない不具合とは、取扱説明書、添付文書及び本研究計画書に記載されていないもの、あるいは記
載されていてもその性質や度合いが記載内容と一致しないものをいう。
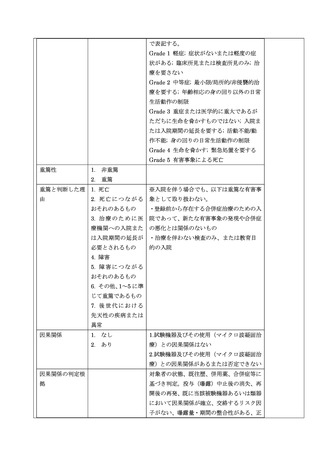
3)重篤な有害事象の定義
重篤な有害事象とは、有害事象のうち、次の 1 から 7 に該当するものとする。
1. 死亡
33
3-B: 手術後 6 か月の前立腺針生検による標的とした前立腺癌病巣の病理組織学的診断においてグリソ
ンスコア 6 以下
それぞれに 2 つずつの条件を設定するため、計 4 つの項目になる(表 7-2 参照)
。
表 7-2 副次評価項目 3)の組合せ
副次評価項目 3)
1.
2-A かつ 3-A の達成
2.
2-A かつ 3-B の達成
3.
2-B かつ 3-A の達成
4,
2-B かつ 3-B の達成
9) PRO(Patient Reported Outcomes)の経時的変化
4-1)EPIC(Expanded Prostate Cancer Index Composite)及び SF-12 の経時的変化(手術前、手術
後 10 日、手術後 1 か月、手術後 3 か月、手術後 6 か月)
4-2)IIEF-15(International Index of Erectile Function)の経時的変化(手術前、手術後 1 か月、手
術後 3 か月、手術後 6 か月)
4-3)EQ5D の経時的変化(手術前、手術後 6 か月)
10) 安全性評価
5-1)手術後 6 か月(または中止時)までの有害事象、不具合の発現と、有害事象の重症度
5-2)手術後 6 か月における尿失禁 (パッド・フリー達成の有無)
7-1.3 安全性を評価するために収集する有害事象
1)有害事象の定義
有害事象とは、試験治療が実施された対象者に生じたすべての疾病若しくは障害又はこれらの徴候、すな
わち、試験治療実施時に生じたすべての好ましくない又は意図しない疾病又は障害並びにその徴候(臨床
検査値の異常を含む。)をいい、試験治療との因果関係の有無は問わない。ただし、被験者以外の者に生じ
たものについては、試験機器の使用による影響と疑われるものに限る。試験治療開始前から存在した事象
(合併症)については、試験治療開始後に悪化したものを有害事象として取り扱う。
2)不具合の定義
不具合とは、試験機器の破損、作動不良等広く品質、安全性、性能等に関する試験機器の具合がよくない
ことをいう。設計、交付、保管、使用のいずれの段階によるものであるかを問わない。不具合による影響
かどうか不明である場合も、不具合による影響に含む。
予測できない不具合とは、取扱説明書、添付文書及び本研究計画書に記載されていないもの、あるいは記
載されていてもその性質や度合いが記載内容と一致しないものをいう。
3)重篤な有害事象の定義
重篤な有害事象とは、有害事象のうち、次の 1 から 7 に該当するものとする。
1. 死亡
33