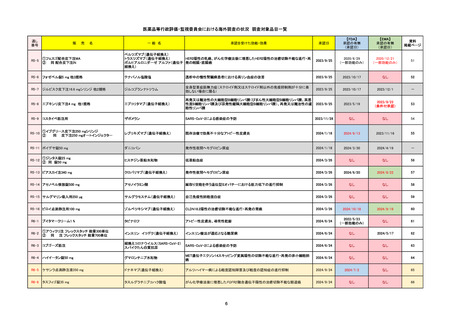
よむ、つかう、まなぶ。
【資料3-4】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[1.2MB] (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
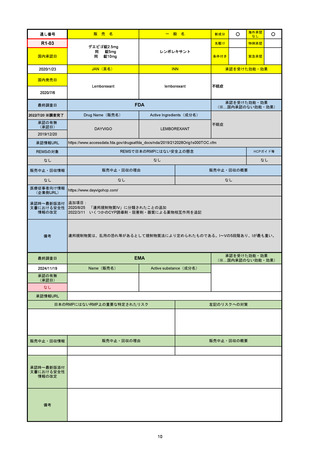
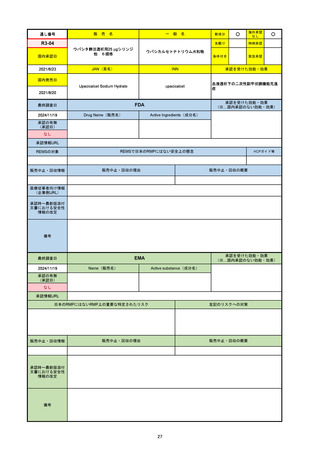
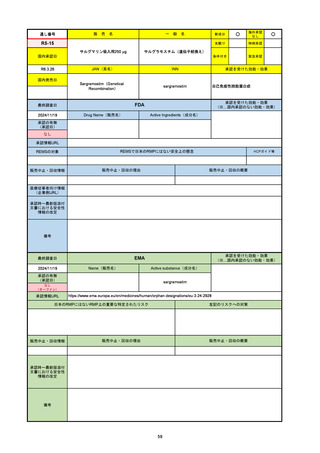
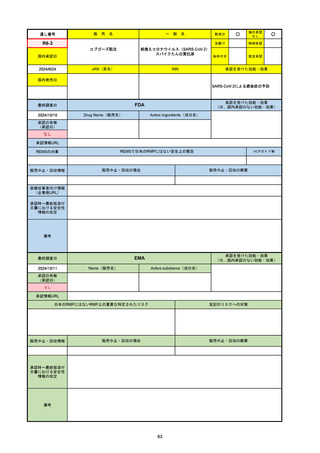
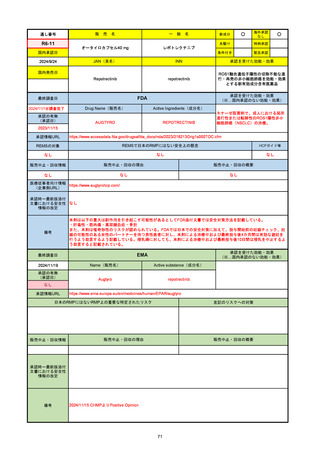
販
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
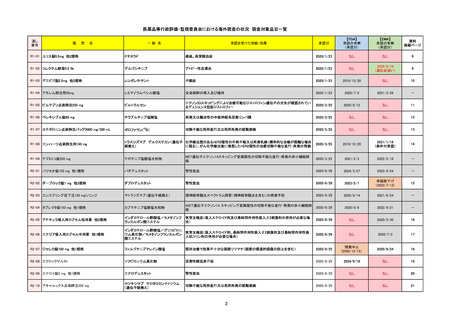
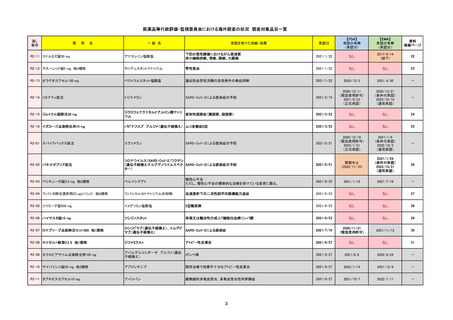
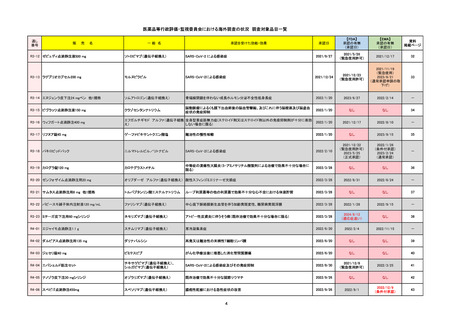
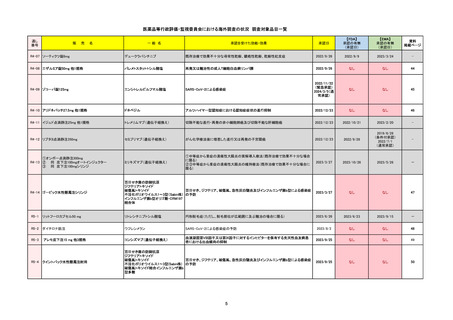
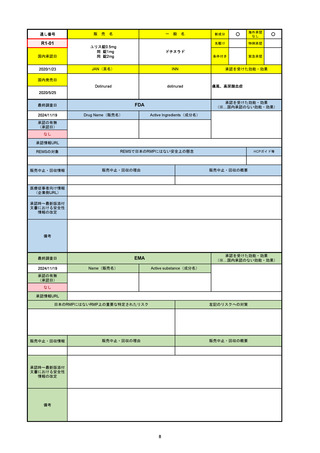
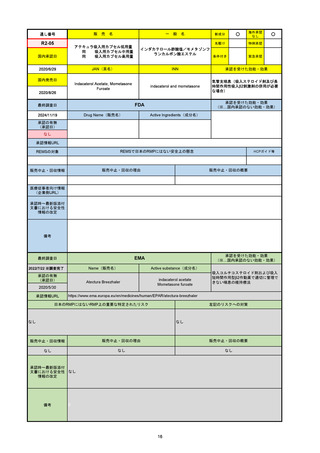
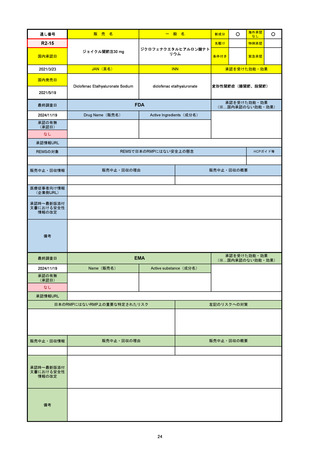
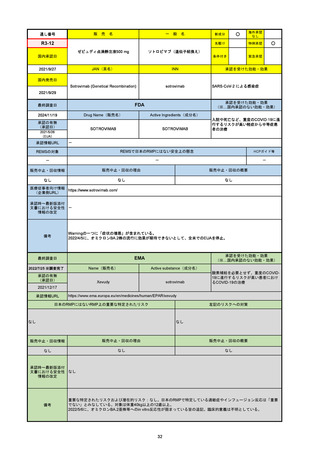
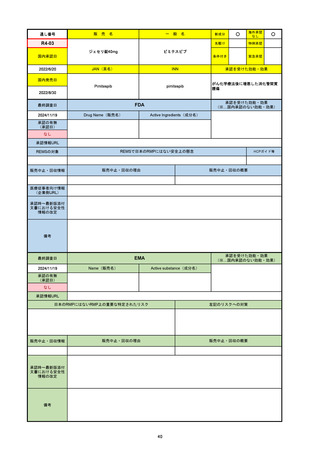
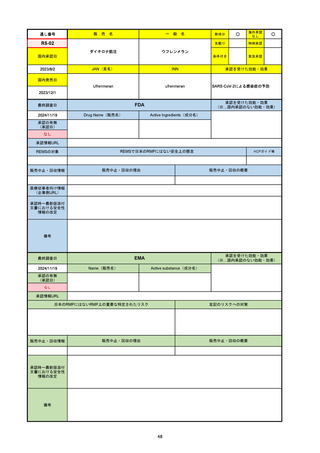
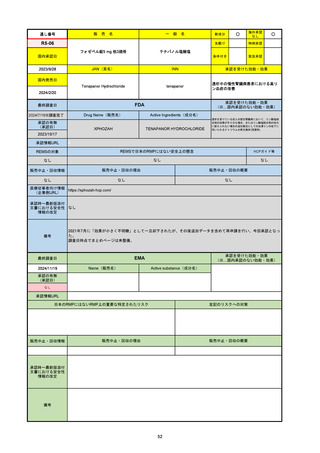
R2-07
国内承認日
2020/9/25
ジセレカ錠100 mg
同 錠200 mg
フィルゴチニブマレイン酸塩
JAN(英名)
INN
承認を受けた効能・効果
Filgotinib maleate
filgotinib
既存治療で効果不十分な関節リウマチ
(関節の構造的損傷の防止を含む)
国内発売日
2020/11/18
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2024/7/18
Drug Name(販売名)
Active Ingredients(成分名)
承認の有無
(承認日)
2020/12/15
開発中止
0
0
承認情報URL
0
0
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
0
0
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
医療従事者向け情報
(企業側URL)
承認時~最新版添付
文書における安全性 0
情報の改定
2020年12月 ギリアド社は米国での本剤承認には大幅な追臨床試験が必要であることから米国での申請を断念した。
https://www.gilead.com/news-and-press/press-room/press-releases/2020/12/gilead-and-galapagos-announce-newcommercialization-and-development-agreement-for-jyseleca-filgotinib
備考
2022/7/22 ※調査完了
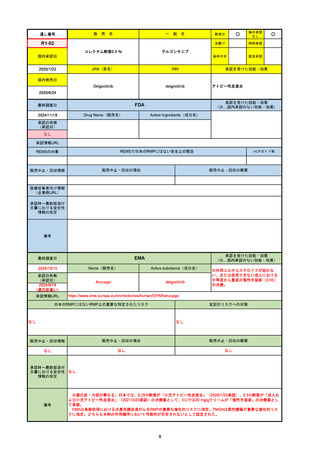
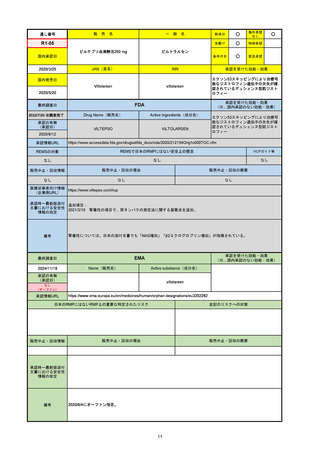
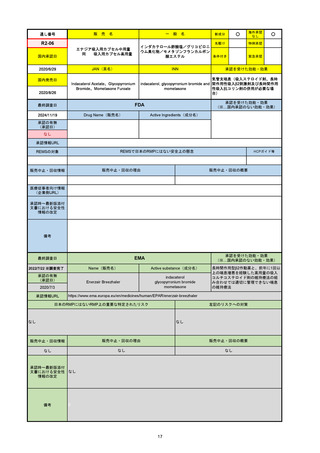
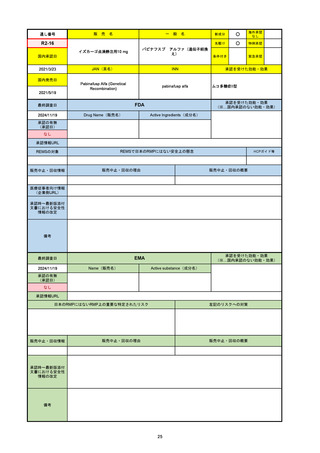
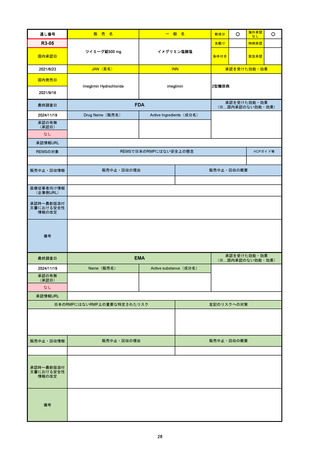
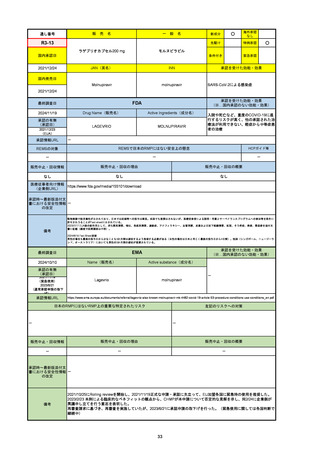
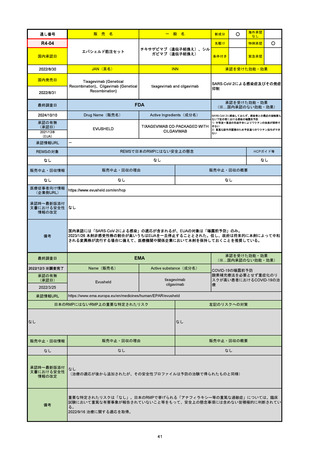
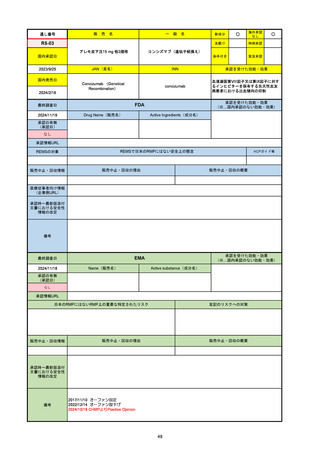
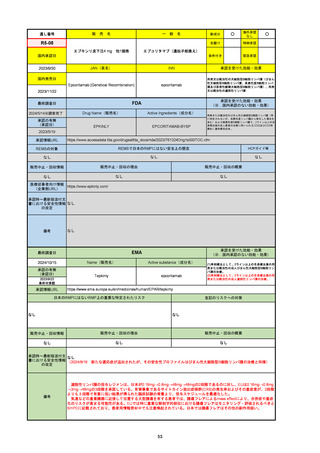
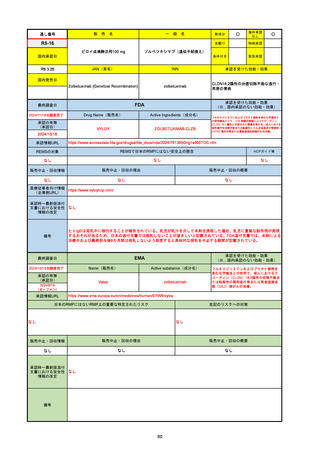
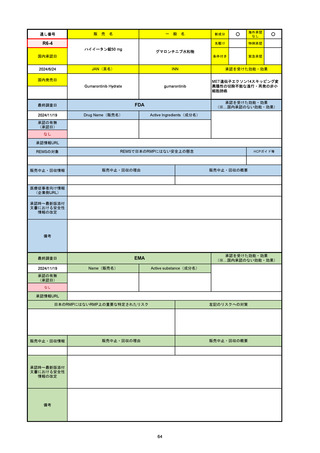
承認の有無
(承認日)
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Jyseleca
Filgotinib maleate
2020/9/24
承認情報URL
1つまたは複数の疾患修飾性抗リウマチ薬への反応性が不十
分であるかまたは不耐性の、中等度から重度の活動性関節
リウマチ
※既存の治療が有効でない中等度から重度の活動性潰瘍性
大腸炎
https://www.ema.europa.eu/en/medicines/human/EPAR/jyseleca
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付 2021/11/16 関節リウマチ(RA)に潰瘍性大腸炎(UC)の適応が加わったため、RMPもRAとUCを適宜分けて表記するよ
文書における安全性
うに記載ぶりを変更。UCに特異的な安全性上の懸念はないが、承認後の観察研究を追加。
情報の改定
備考
重要な特定されたリスクは「日和見感染症」と「帯状疱疹」で、いずれも日本のRMPに記載されている。
2021/11/12に活動性潰瘍性大腸炎の適応が追加。
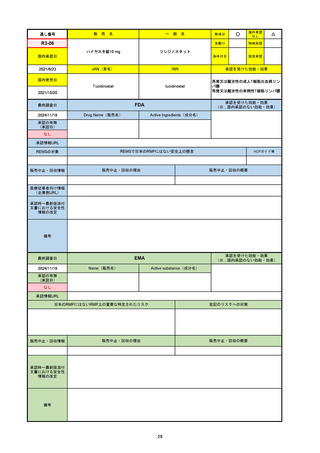
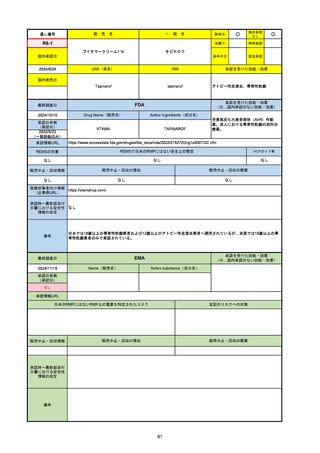
18
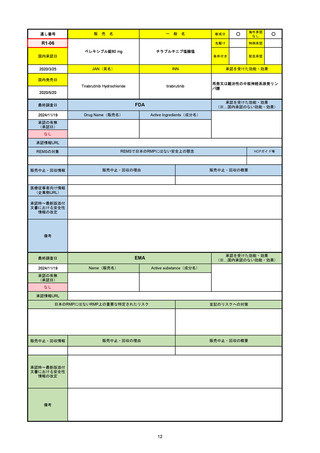
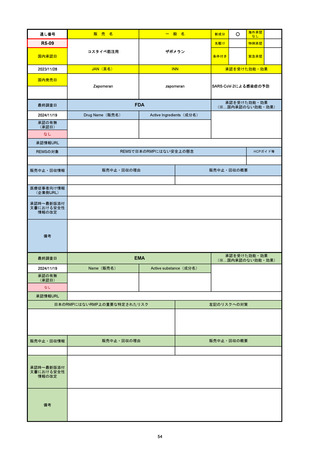
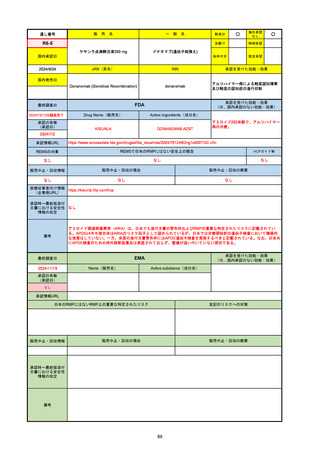
通し番号
売
名
一
般
新成分
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
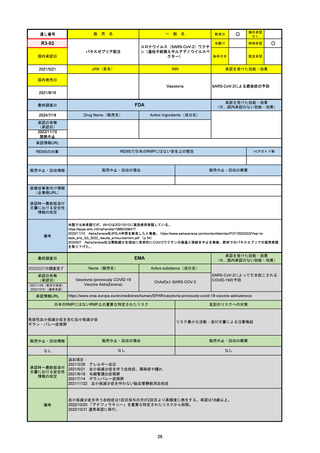
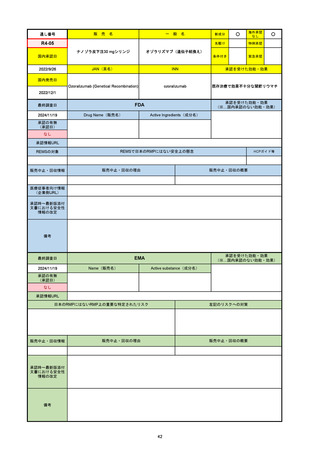
R2-07
国内承認日
2020/9/25
ジセレカ錠100 mg
同 錠200 mg
フィルゴチニブマレイン酸塩
JAN(英名)
INN
承認を受けた効能・効果
Filgotinib maleate
filgotinib
既存治療で効果不十分な関節リウマチ
(関節の構造的損傷の防止を含む)
国内発売日
2020/11/18
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
2024/7/18
Drug Name(販売名)
Active Ingredients(成分名)
承認の有無
(承認日)
2020/12/15
開発中止
0
0
承認情報URL
0
0
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
0
0
0
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
0
0
0
医療従事者向け情報
(企業側URL)
承認時~最新版添付
文書における安全性 0
情報の改定
2020年12月 ギリアド社は米国での本剤承認には大幅な追臨床試験が必要であることから米国での申請を断念した。
https://www.gilead.com/news-and-press/press-room/press-releases/2020/12/gilead-and-galapagos-announce-newcommercialization-and-development-agreement-for-jyseleca-filgotinib
備考
2022/7/22 ※調査完了
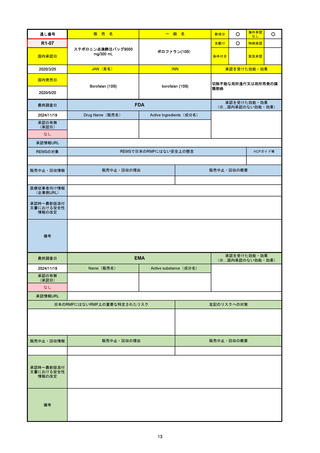
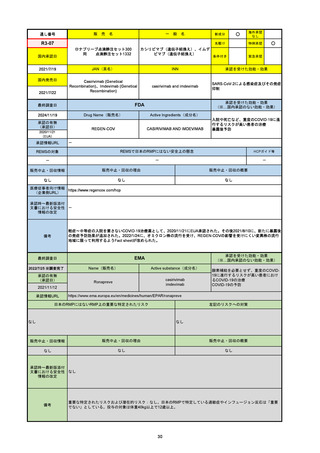
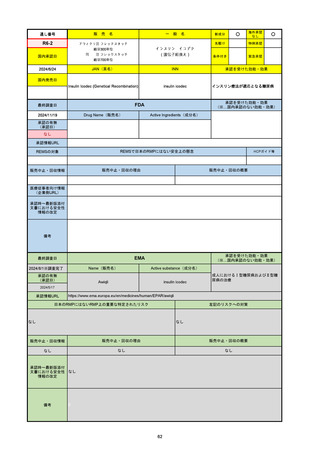
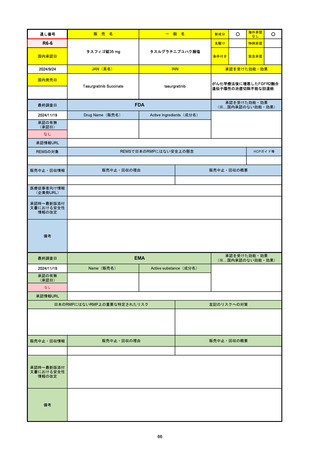
承認の有無
(承認日)
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Jyseleca
Filgotinib maleate
2020/9/24
承認情報URL
1つまたは複数の疾患修飾性抗リウマチ薬への反応性が不十
分であるかまたは不耐性の、中等度から重度の活動性関節
リウマチ
※既存の治療が有効でない中等度から重度の活動性潰瘍性
大腸炎
https://www.ema.europa.eu/en/medicines/human/EPAR/jyseleca
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付 2021/11/16 関節リウマチ(RA)に潰瘍性大腸炎(UC)の適応が加わったため、RMPもRAとUCを適宜分けて表記するよ
文書における安全性
うに記載ぶりを変更。UCに特異的な安全性上の懸念はないが、承認後の観察研究を追加。
情報の改定
備考
重要な特定されたリスクは「日和見感染症」と「帯状疱疹」で、いずれも日本のRMPに記載されている。
2021/11/12に活動性潰瘍性大腸炎の適応が追加。
18