よむ、つかう、まなぶ。
【資料3-4】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[1.2MB] (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
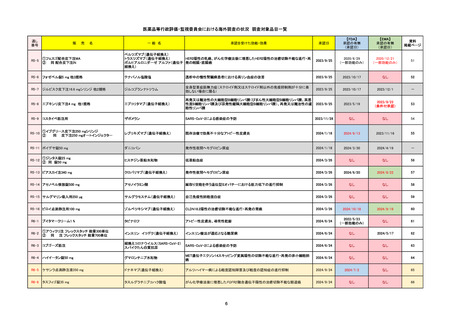
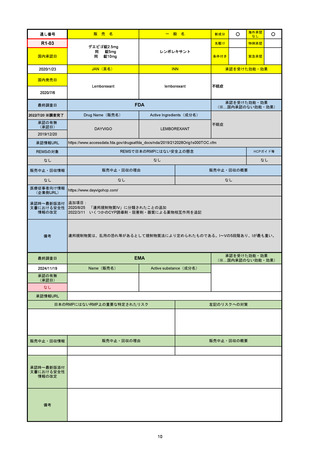
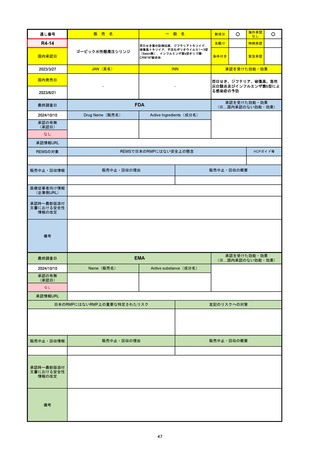
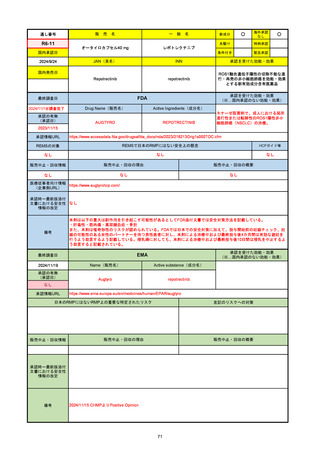
販 売
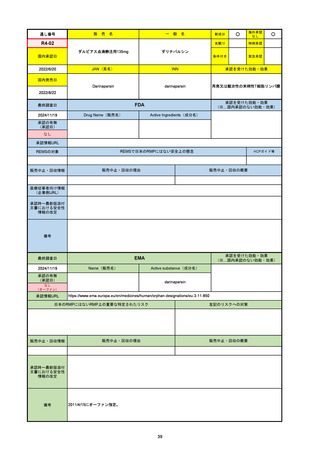
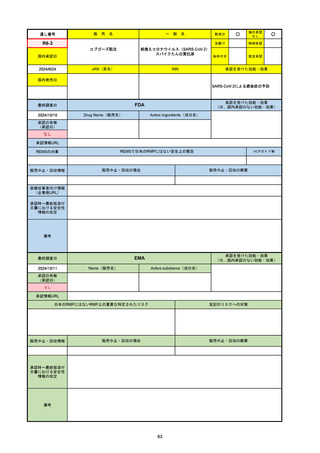
通し番号
名
一
般
新成分
〇
海外承認
なし
〇
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
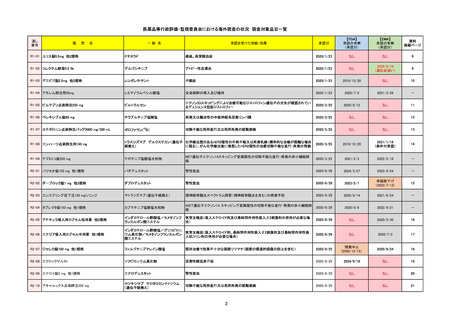
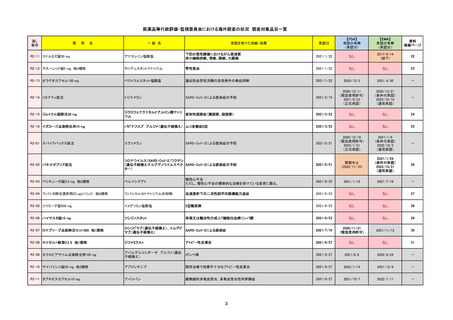
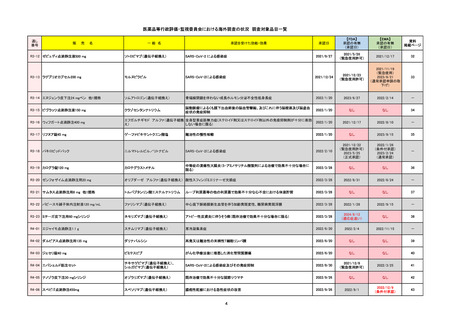
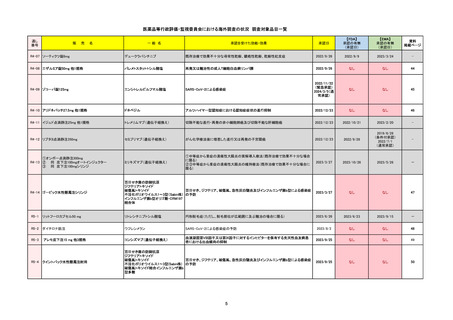
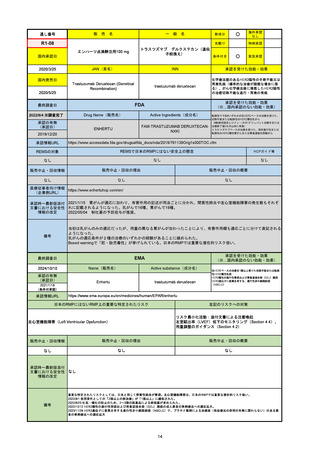
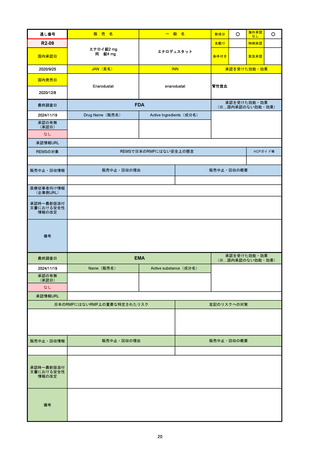
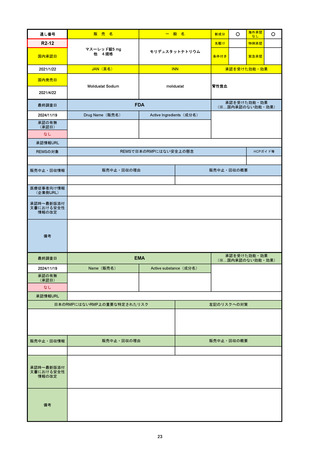
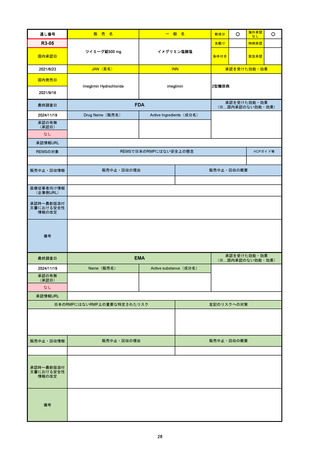
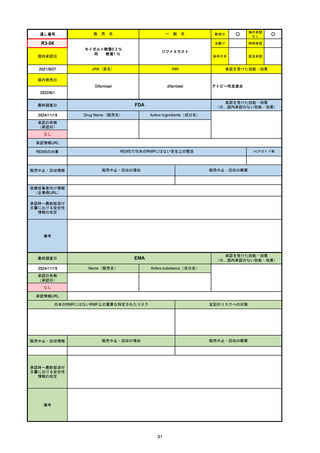
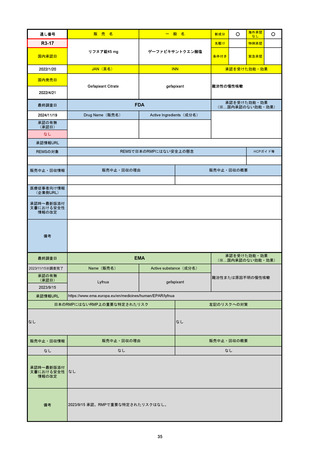
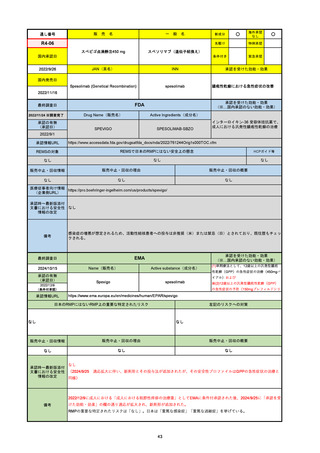
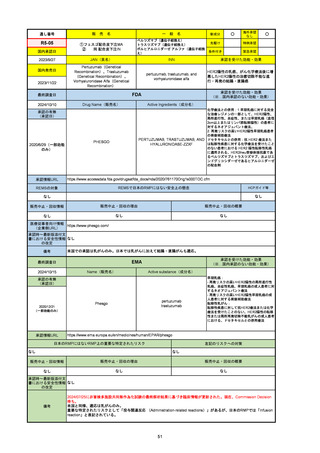
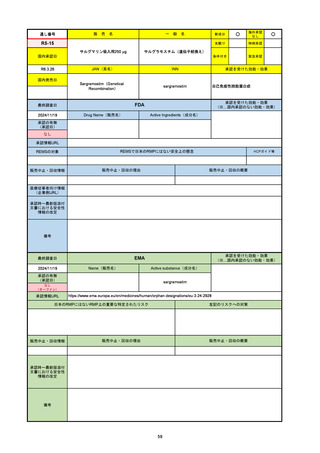
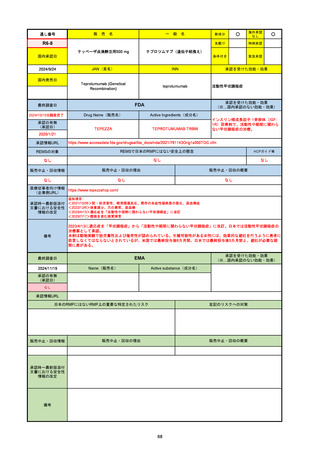
R5-08
エプキンリ皮下注4 mg 他1規格
エプコリタマブ(遺伝子組換え)
国内承認日
JAN(英名)
INN
承認を受けた効能・効果
Epcoritamab (Genetical Recombination)
epcoritamab
再発又は難治性の大細胞型B細胞リンパ腫(びまん
性大細胞型B細胞リンパ腫、高悪性度B細胞リンパ
腫及び原発性縦隔大細胞型B細胞リンパ腫)、再発
又は難治性の濾胞性リンパ腫
2023/9/30
国内発売日
2023/11/22
承認を受けた効能・効果
(※…国内承認のない効能・効果)
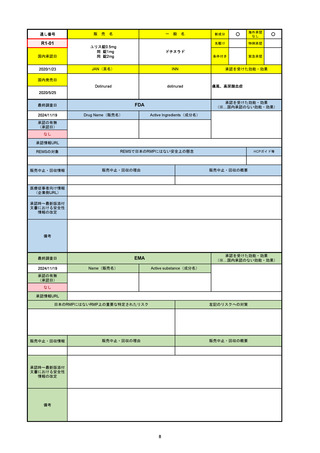
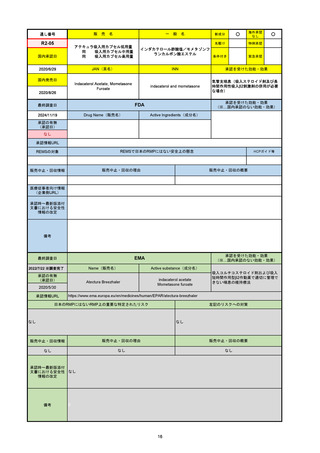
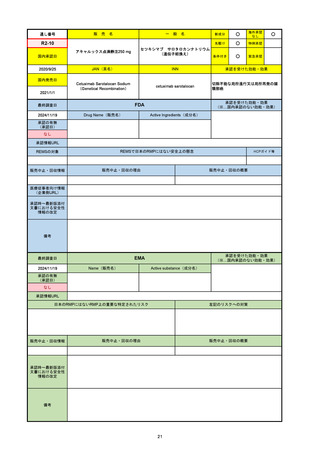
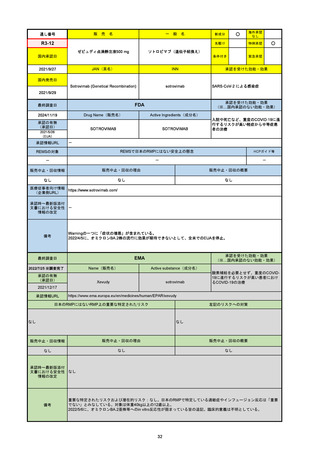
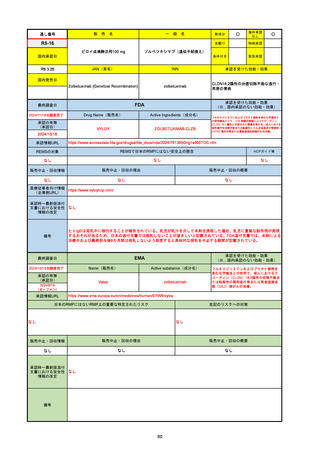
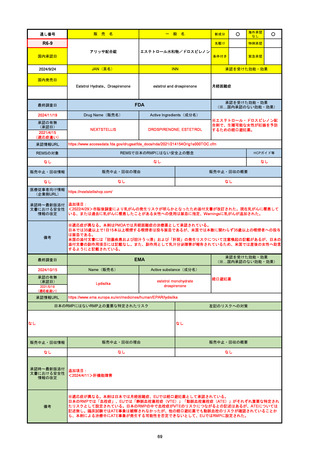
FDA
最終調査日
2024/5/14※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
EPKINLY
EPCORITAMAB-BYSP
2023/5/19
承認情報URL
再発または難治性のびまん性大細胞型B細胞リンパ腫(特
に特定されないが、低悪性度リンパ腫から発生した場合を
含む)および高悪性度B細胞リンパ腫で、2ライン以上の全
身療法後の成人患者の治療に用いられるCD20及びCD3特
異的二重特異性抗体。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/761324Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.epkinly.com/
(企業側URL)
承認時~最新版添付文
書における安全性情報 なし
の改定
なし
備考
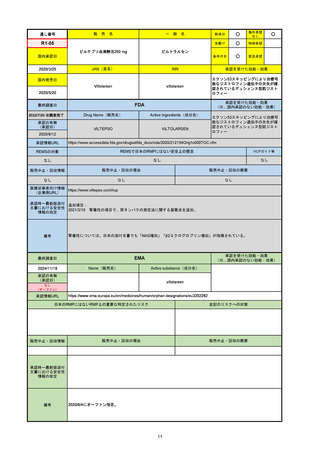
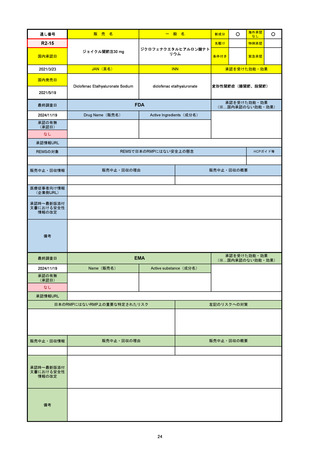
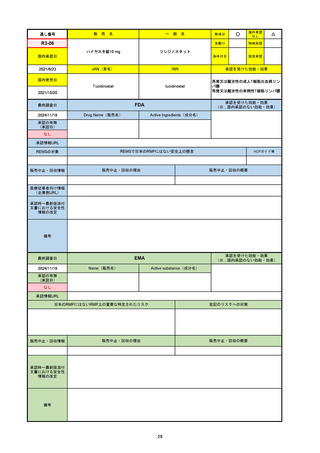
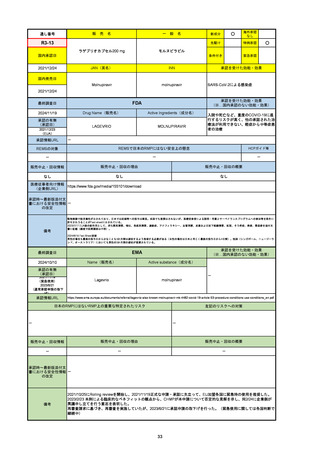
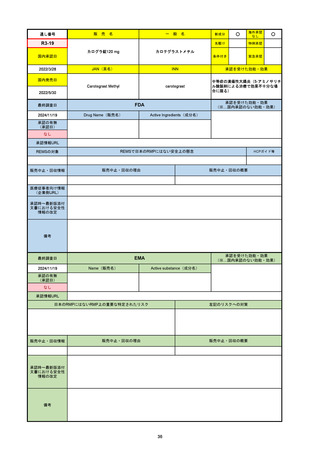
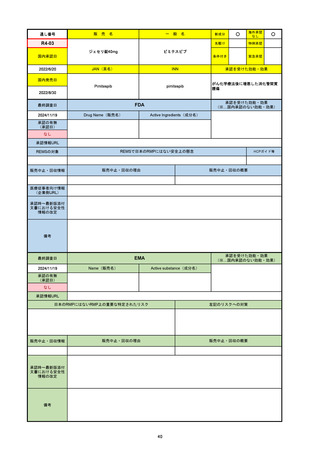
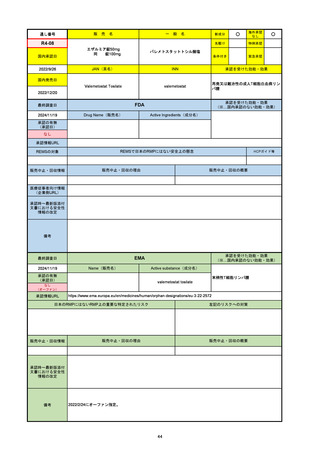
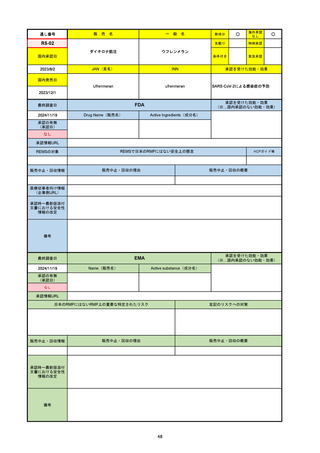
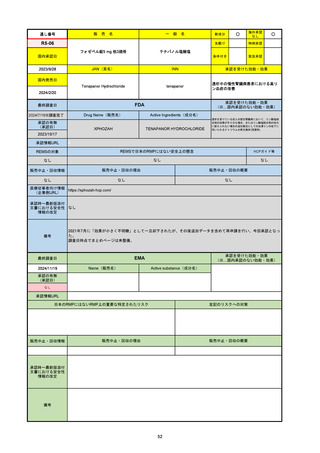
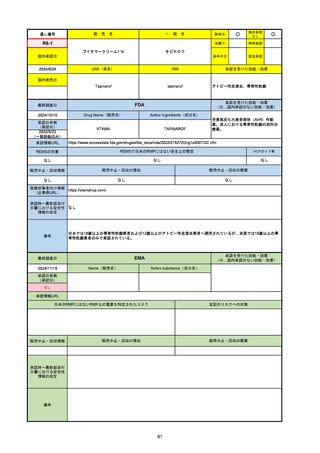
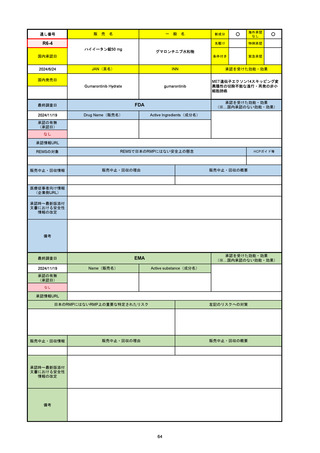
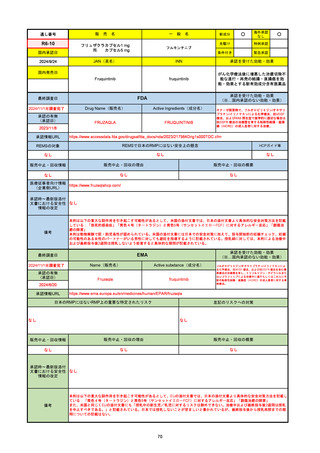
2024/10/15
承認の有無
(承認日)
2023/9/22
条件付承認
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
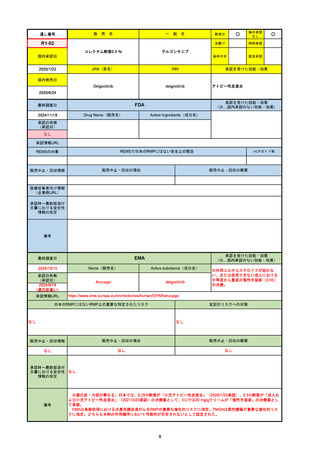
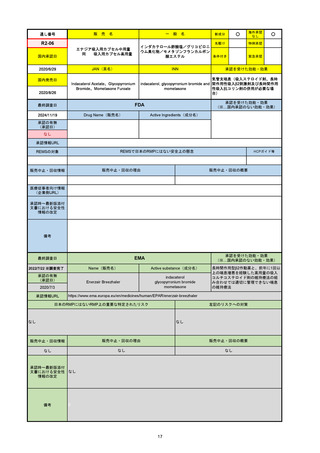
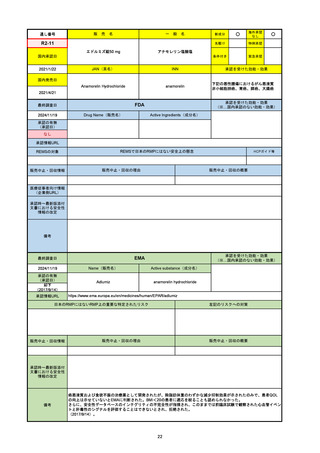
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Tepkinly
epcoritamab
(1)単剤療法として、2ライン以上の全身療法後の再
発または難治性の成人びまん性大細胞型B細胞リン
パ腫の治療。
(2)単剤療法として、2ライン以上の全身療法後の再
発または難治性の成人濾胞性リンパ腫の治療。
https://www.ema.europa.eu/en/medicines/human/EPAR/tepkinly
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文 なし
書における安全性情報 (2024/8/16 新たな適応症が追加されたが、その安全性プロファイルはびまん性大細胞型B細胞リンパ腫の治療と同様)
の改定
備考
濾胞性リンパ腫の投与レジメンは、日本が0.16mg→0.8mg→48mg→48mgの2段階であるのに対し、EUは0.16mg→0.8mg
→3mg→48mgの3段階を承認している。有害事象であるサイトカイン放出症候群(CRS)の発生率およびその重症度が、2段階
よりも3段階で有意に低い結果が得られた臨床試験の背景より、投与スケジュールを最適化した。
気道などの重要臓器に近接して位置する大型腫瘍を有する患者では、腫瘍フレアによるmass effectにより、合併症や重症
化のリスクが高まる可能性がある。EUでは特に重要な解剖学的部位における腫瘍フレアはモニタリング・評価されるべきと
SmPCに記載されており、患者用情報資材中でも注意喚起されている。日本では腫瘍フレアはその他の副作用扱い。
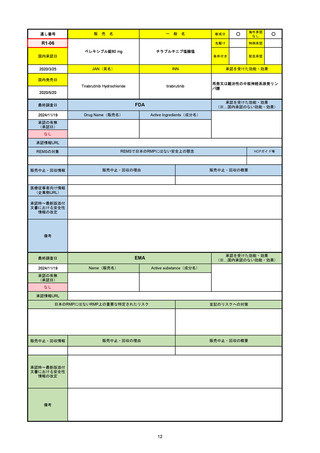
53
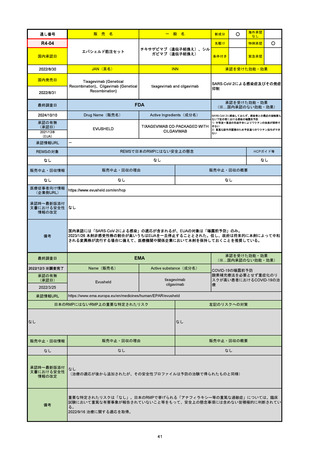
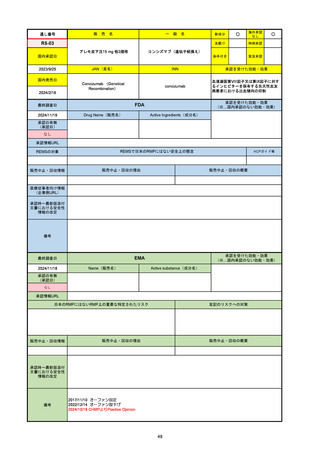
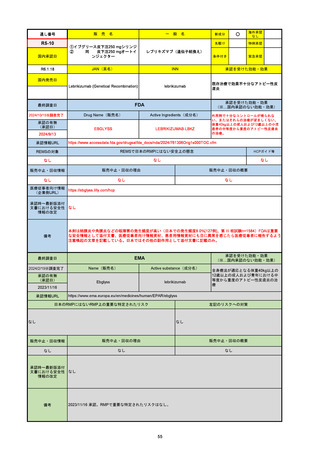
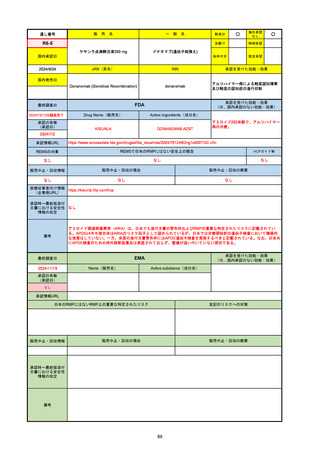
通し番号
名
一
般
新成分
〇
海外承認
なし
〇
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
名
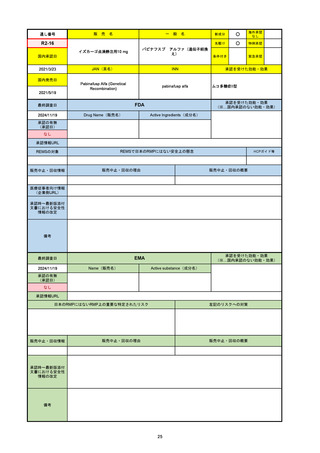
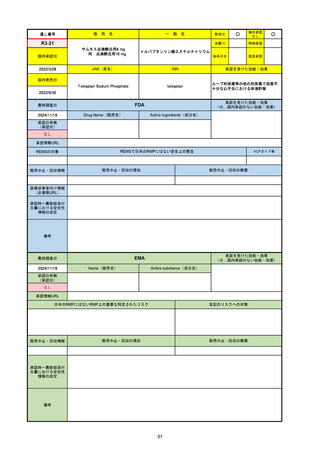
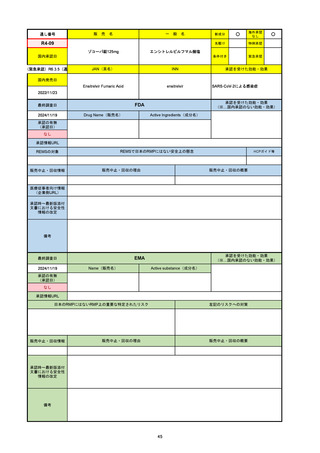
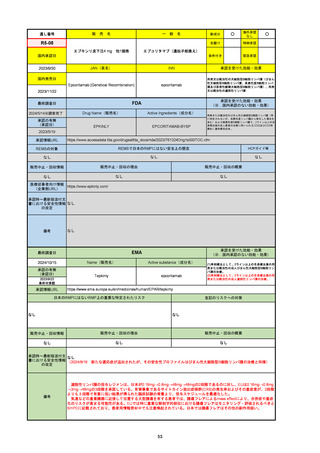
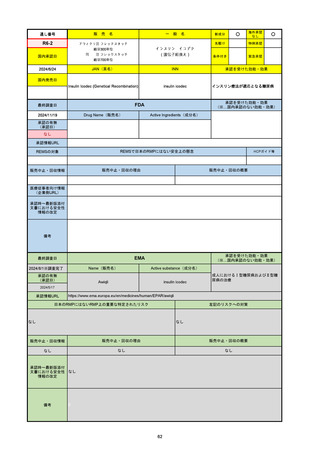
R5-08
エプキンリ皮下注4 mg 他1規格
エプコリタマブ(遺伝子組換え)
国内承認日
JAN(英名)
INN
承認を受けた効能・効果
Epcoritamab (Genetical Recombination)
epcoritamab
再発又は難治性の大細胞型B細胞リンパ腫(びまん
性大細胞型B細胞リンパ腫、高悪性度B細胞リンパ
腫及び原発性縦隔大細胞型B細胞リンパ腫)、再発
又は難治性の濾胞性リンパ腫
2023/9/30
国内発売日
2023/11/22
承認を受けた効能・効果
(※…国内承認のない効能・効果)
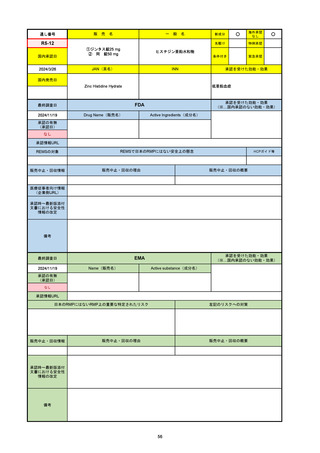
FDA
最終調査日
2024/5/14※調査完了
承認の有無
(承認日)
Drug Name(販売名)
Active Ingredients(成分名)
EPKINLY
EPCORITAMAB-BYSP
2023/5/19
承認情報URL
再発または難治性のびまん性大細胞型B細胞リンパ腫(特
に特定されないが、低悪性度リンパ腫から発生した場合を
含む)および高悪性度B細胞リンパ腫で、2ライン以上の全
身療法後の成人患者の治療に用いられるCD20及びCD3特
異的二重特異性抗体。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2023/761324Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.epkinly.com/
(企業側URL)
承認時~最新版添付文
書における安全性情報 なし
の改定
なし
備考
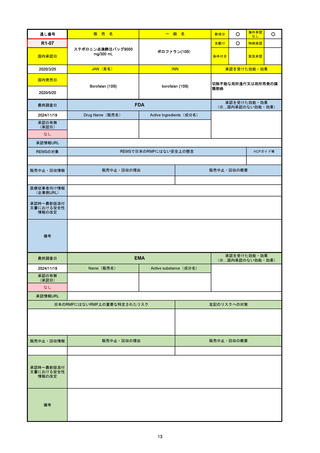
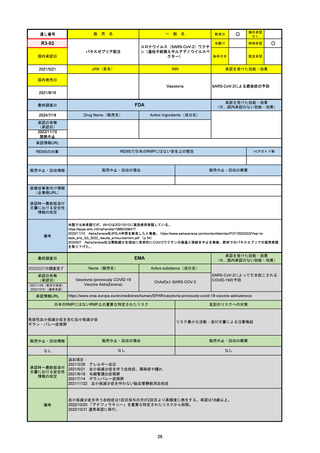
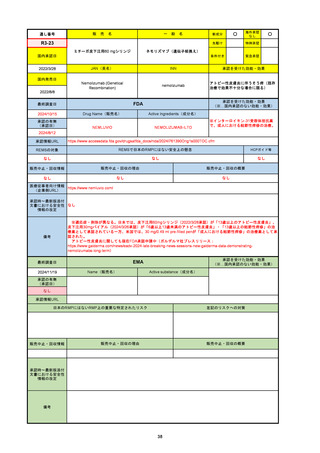
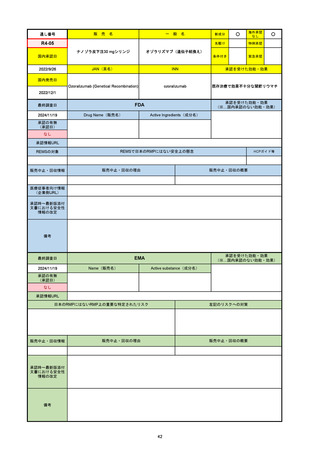
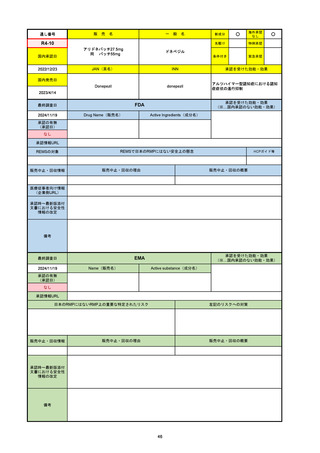
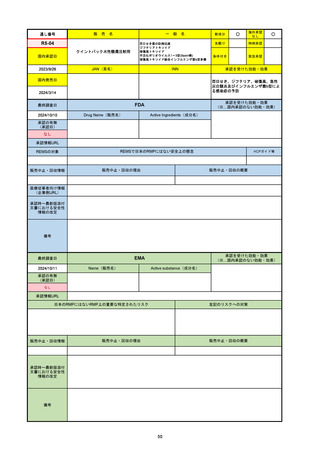
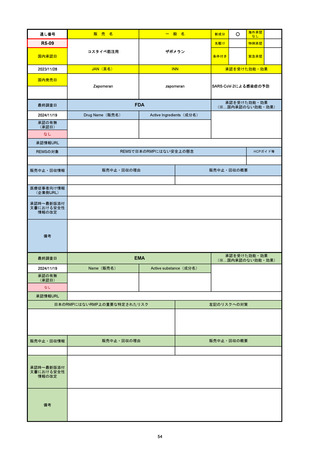
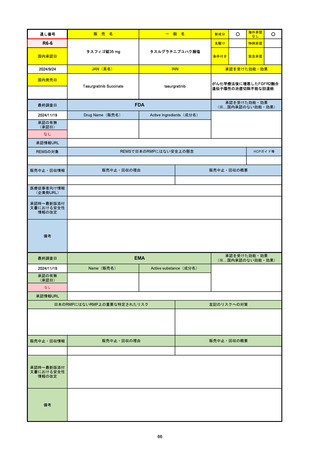
2024/10/15
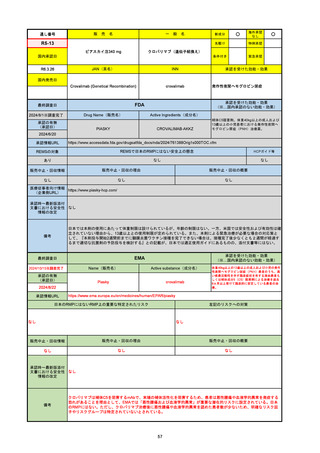
承認の有無
(承認日)
2023/9/22
条件付承認
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
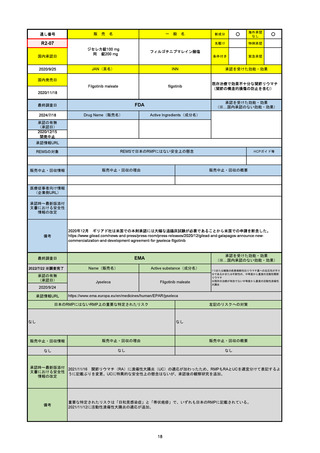
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Tepkinly
epcoritamab
(1)単剤療法として、2ライン以上の全身療法後の再
発または難治性の成人びまん性大細胞型B細胞リン
パ腫の治療。
(2)単剤療法として、2ライン以上の全身療法後の再
発または難治性の成人濾胞性リンパ腫の治療。
https://www.ema.europa.eu/en/medicines/human/EPAR/tepkinly
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付文 なし
書における安全性情報 (2024/8/16 新たな適応症が追加されたが、その安全性プロファイルはびまん性大細胞型B細胞リンパ腫の治療と同様)
の改定
備考
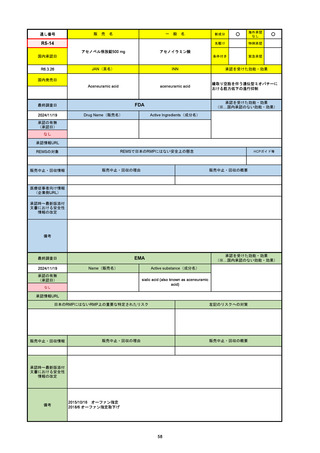
濾胞性リンパ腫の投与レジメンは、日本が0.16mg→0.8mg→48mg→48mgの2段階であるのに対し、EUは0.16mg→0.8mg
→3mg→48mgの3段階を承認している。有害事象であるサイトカイン放出症候群(CRS)の発生率およびその重症度が、2段階
よりも3段階で有意に低い結果が得られた臨床試験の背景より、投与スケジュールを最適化した。
気道などの重要臓器に近接して位置する大型腫瘍を有する患者では、腫瘍フレアによるmass effectにより、合併症や重症
化のリスクが高まる可能性がある。EUでは特に重要な解剖学的部位における腫瘍フレアはモニタリング・評価されるべきと
SmPCに記載されており、患者用情報資材中でも注意喚起されている。日本では腫瘍フレアはその他の副作用扱い。
53