よむ、つかう、まなぶ。
【資料3-4】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[1.2MB] (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
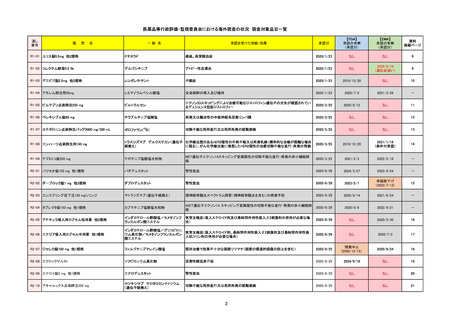
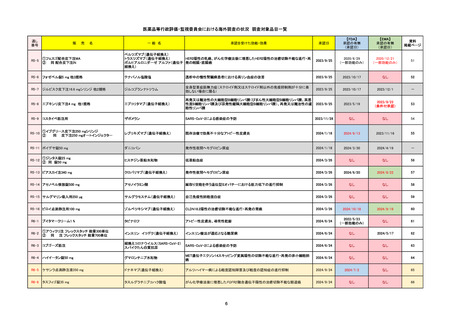
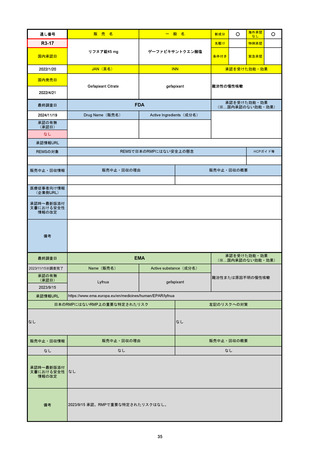
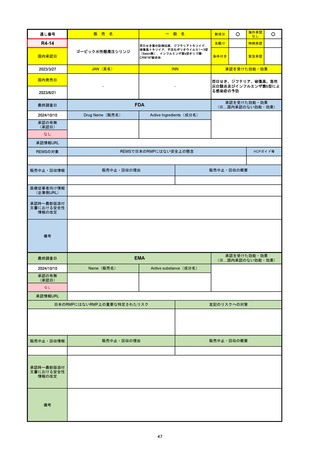
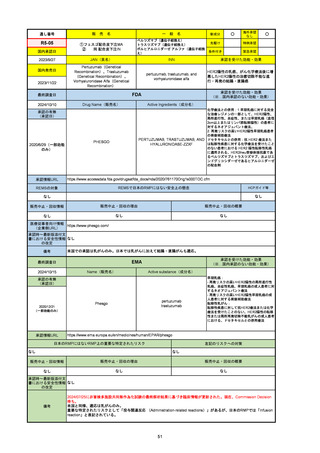
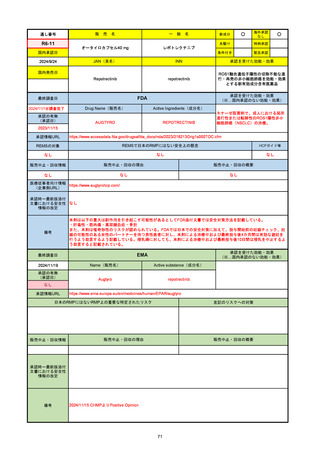
販 売
通し番号
名
一
般
名
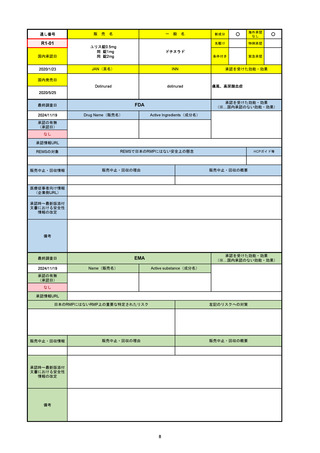
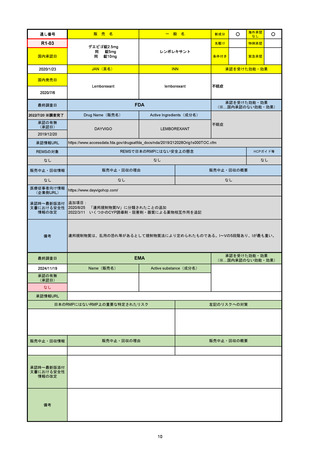
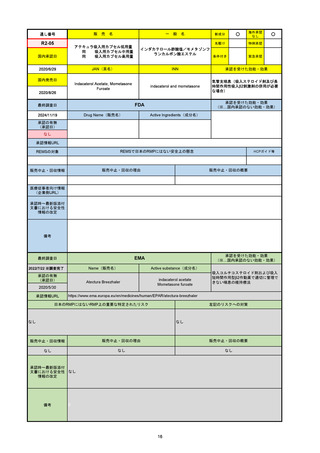
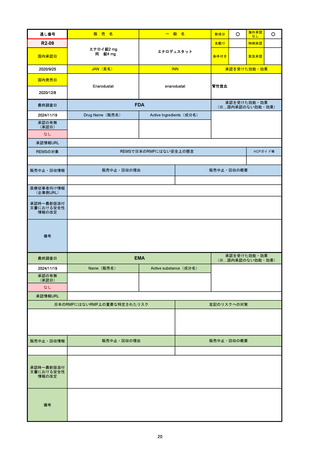
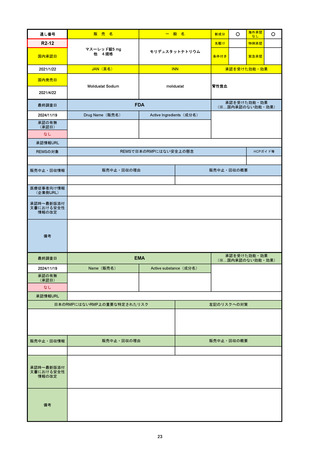
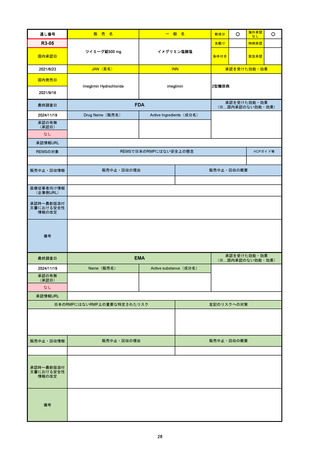
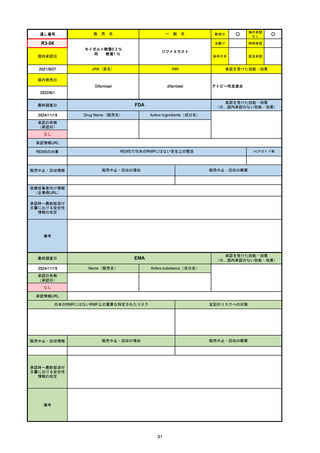
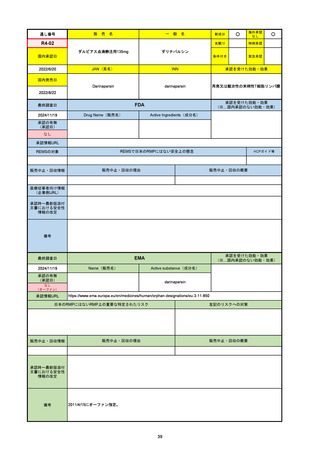
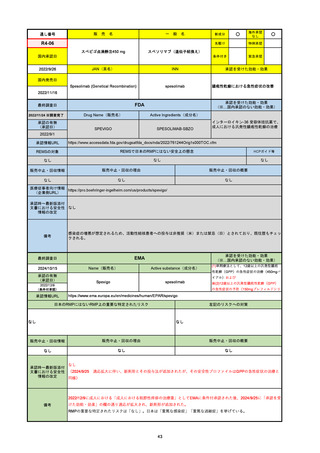
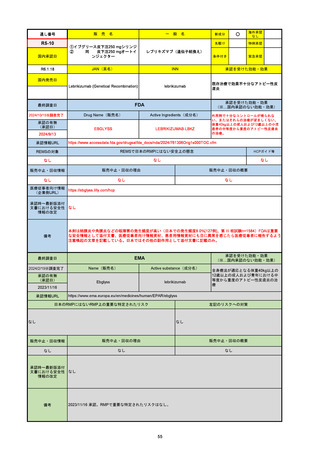
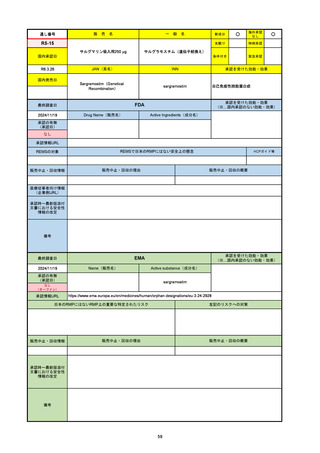
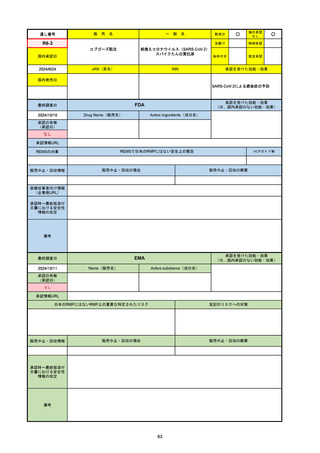
R3-13
ラゲブリオカプセル200 mg
○
海外承認
なし
0
先駆け
0
特例承認
○
条件付き
0
緊急承認
0
モルヌピラビル
国内承認日
2021/12/24
新成分
JAN(英名)
INN
Molnupiravir
molnupiravir
承認を受けた効能・効果
国内発売日
SARS-CoV-2による感染症
2021/12/24
2024/11/19
承認の有無
(承認日)
2021/12/23
(EUA)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
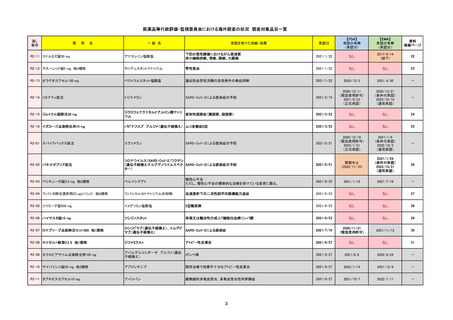
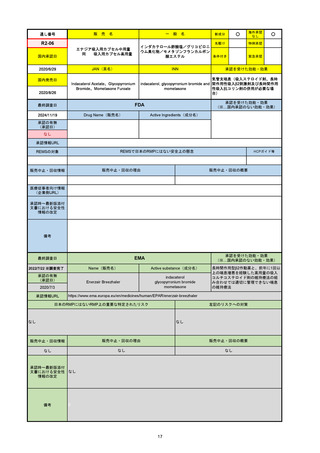
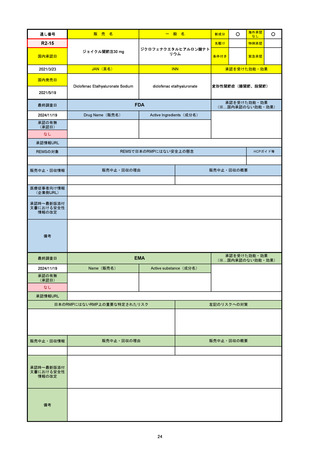
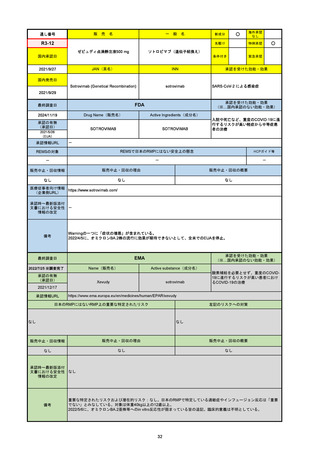
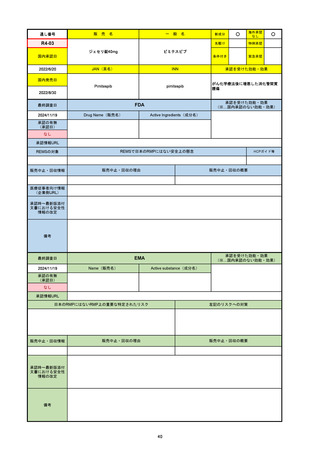
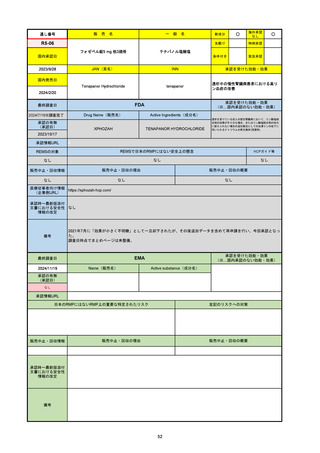
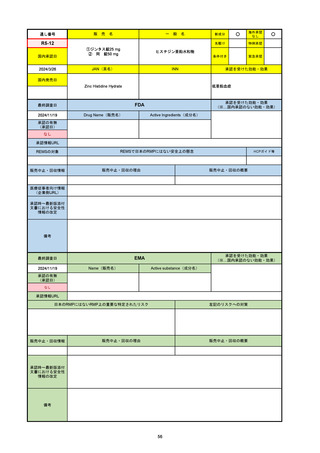
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
LAGEVRIO
MOLNUPIRAVIR
入院や死亡など、重度のCOVID-19に進
行するリスクが高く、他の承認された治
療法が利用できない、軽症から中等症患
者の治療
-
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
-
-
-
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.fda.gov/media/155101/download
(企業側URL)
承認時~最新版添付文
書における安全性情報 -
の改定
動物実験で胎児毒性が示されており、日本では妊婦等への投与は禁忌。米国でも推奨はされないが、医療従事者による説明・同意とサーベイランスプログラムへの参加等を条件に
許可されうることがFact sheetに示されている。
2023/7/17 EUA後の副作用として、消化器系障害、嘔吐、免疫系障害、過敏症、アナフィラキシー、血管浮腫、皮膚および皮下組織障害、紅斑、そう痒症、発疹、蕁麻疹を添付文
書に記載(頻度や因果関係は不明)。
備考
2024/6/18 Fact Sheet更新
男性の場合も最後の投与日から少なくとも3か月間は避妊するよう指導する必要がある(女性の場合は日本と同じく最後の投与日から4日間)。他国(シンガポール、ニュージーラ
ンド、オーストラリア)においても男性の3か月間の避妊が推奨されている。
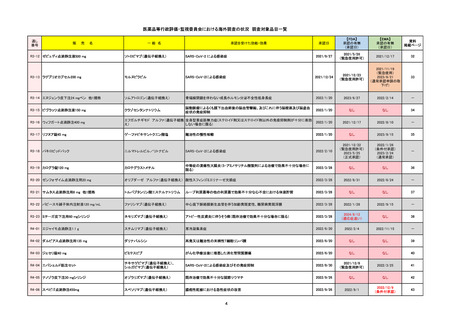
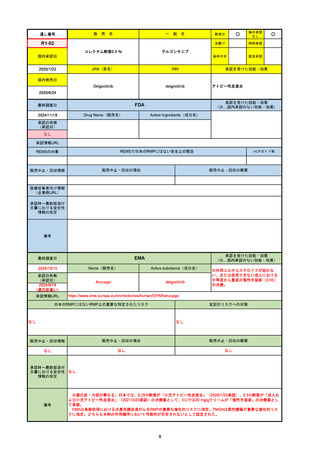
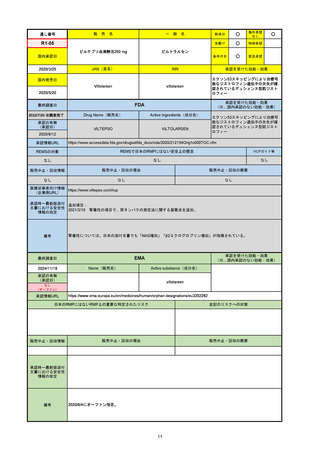
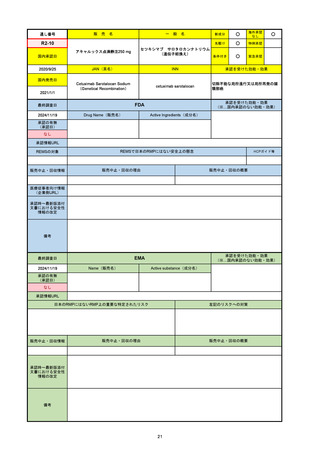
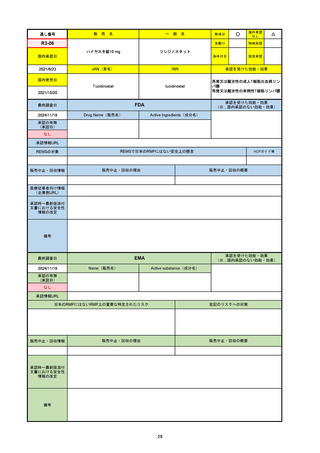
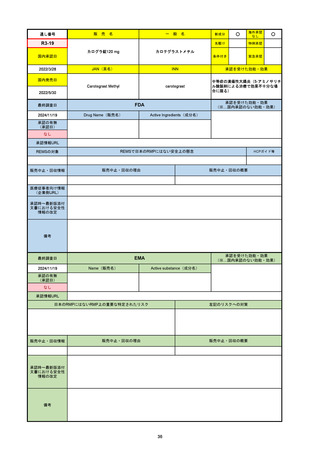
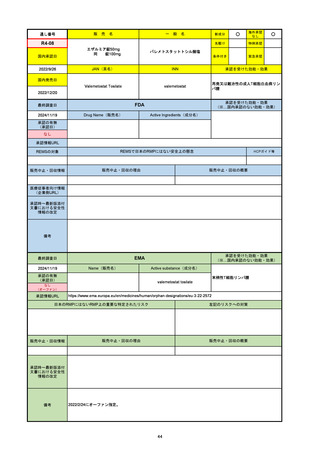
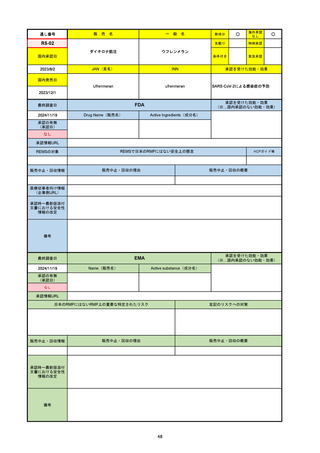
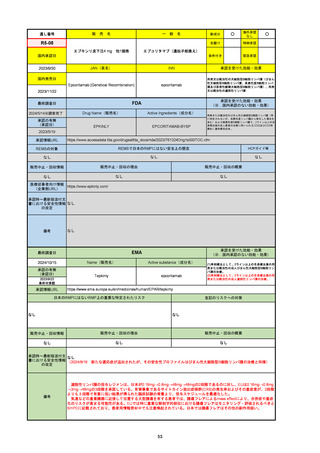
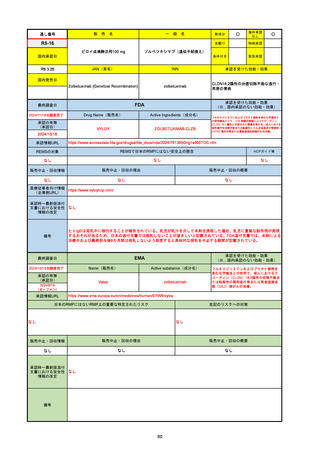
承認を受けた効能・効果
(※…国内承認のない効能・効果)
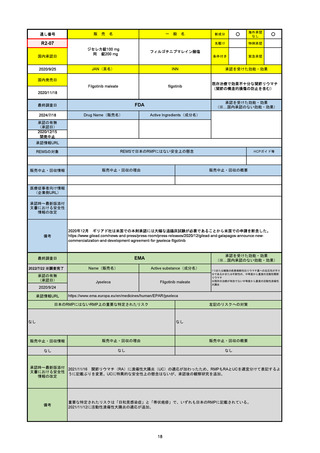
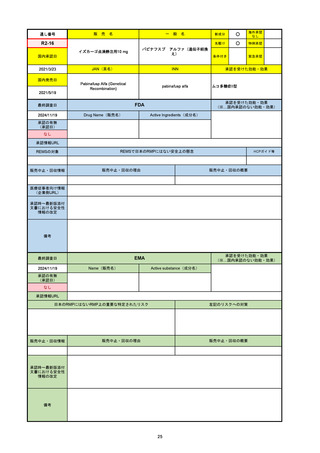
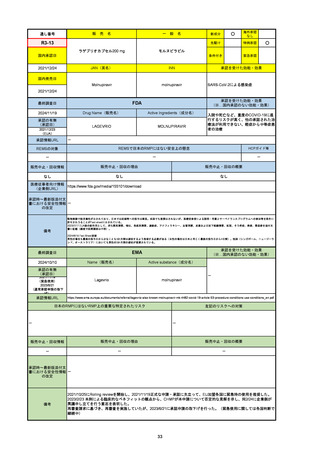
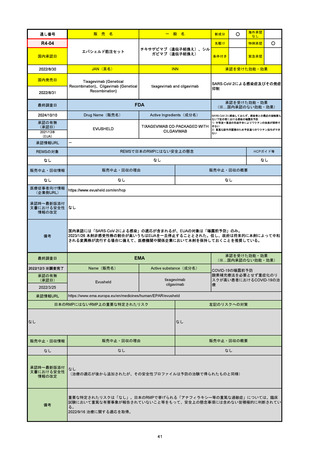
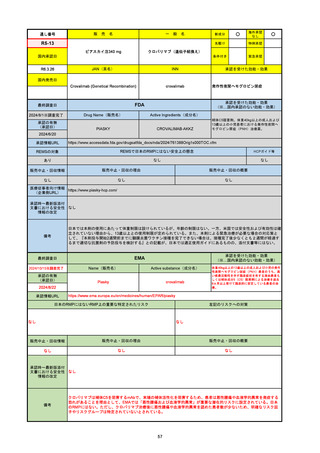
EMA
最終調査日
2024/10/10
Name(販売名)
Active substance(成分名)
Lagevrio
molnupiravir
承認の有無
(承認日)
-
2021/11/19
(緊急使用)
2023/6/21
(通常承認申請の取下
げ)
承認情報URL
https://www.ema.europa.eu/documents/referral/lagevrio-also-known-molnupiravir-mk-4482-covid-19-article-53-procedure-conditions-use-conditions_en.pdf
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
-
-
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
-
-
-
承認時~最新版添付文
書における安全性情報 -
の改定
備考
2021/10/25にRolling reviewを開始し、2021/11/19正式な申請・承認に先立って、EU加盟各国に緊急時の使用を推奨した。
2023/2/23 本剤による臨床的なベネフィットの観点から、CHMPが本申請について否定的な見解を示し、同2/24に企業側が
異議申し立てを行う意志を表明した。
再審査請求に基づき、再審査を実施していたが、2023/6/21に承認申請の取下げを行った。(緊急使用に関しては各国判断で
継続中)
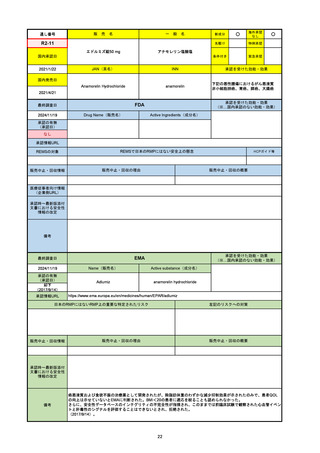
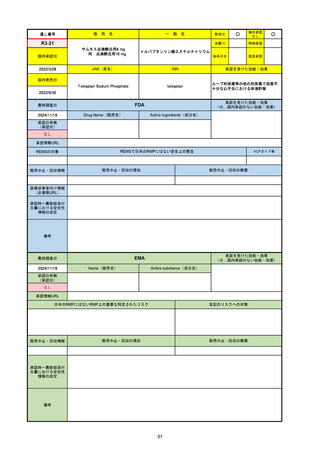
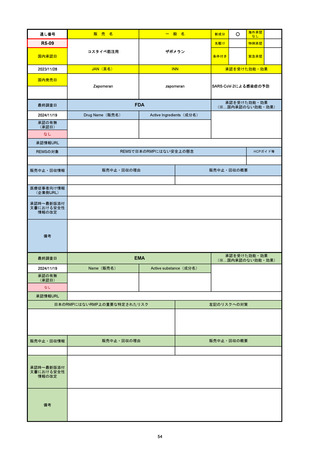
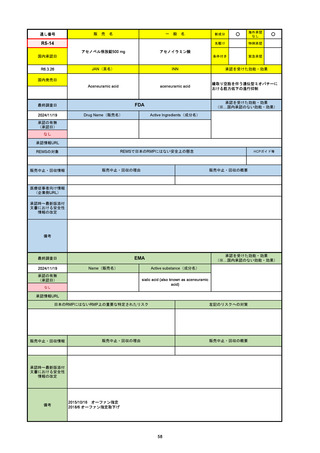
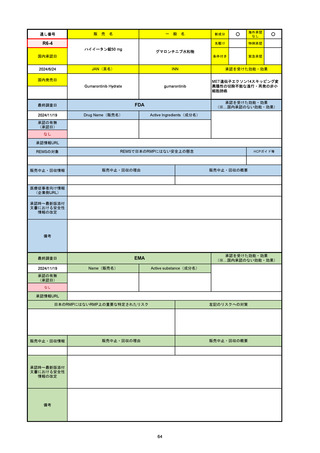
33
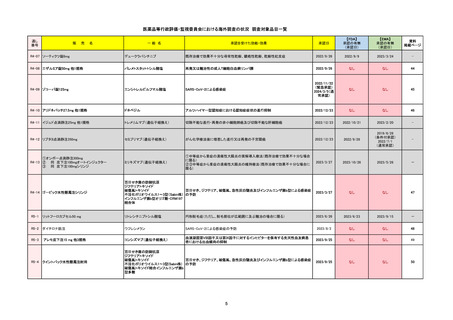
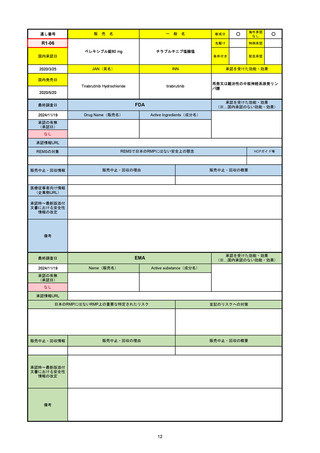
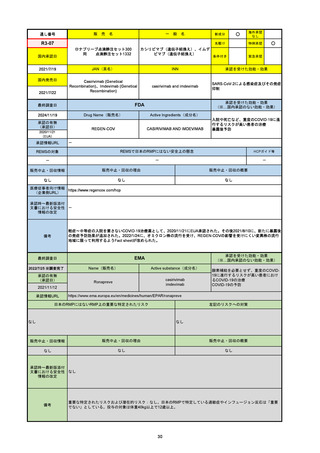
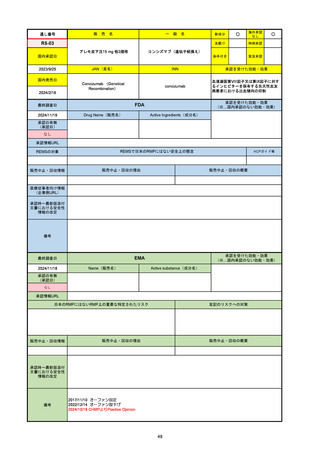
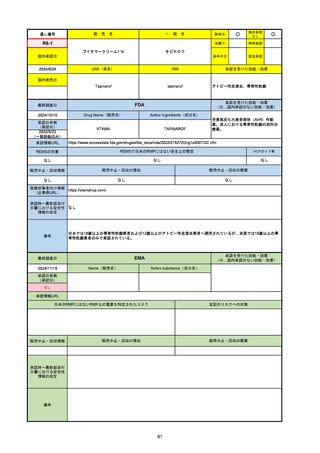
通し番号
名
一
般
名
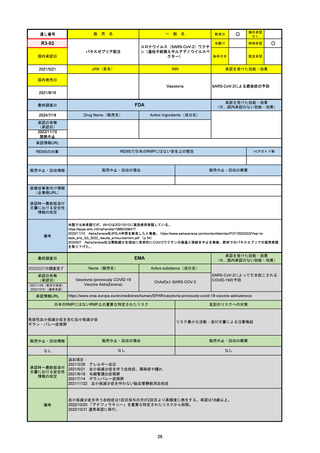
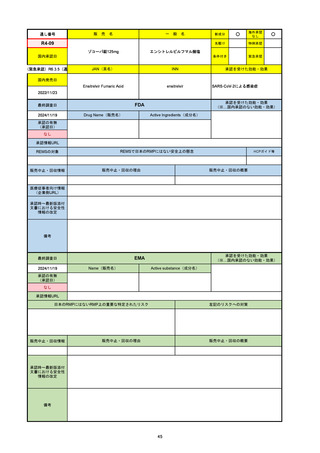
R3-13
ラゲブリオカプセル200 mg
○
海外承認
なし
0
先駆け
0
特例承認
○
条件付き
0
緊急承認
0
モルヌピラビル
国内承認日
2021/12/24
新成分
JAN(英名)
INN
Molnupiravir
molnupiravir
承認を受けた効能・効果
国内発売日
SARS-CoV-2による感染症
2021/12/24
2024/11/19
承認の有無
(承認日)
2021/12/23
(EUA)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
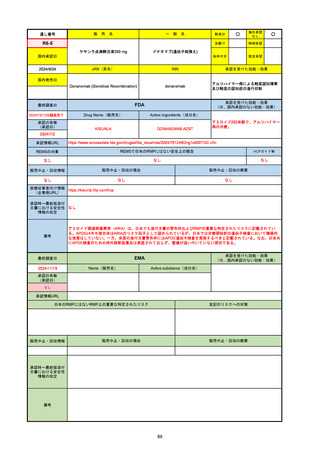
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
LAGEVRIO
MOLNUPIRAVIR
入院や死亡など、重度のCOVID-19に進
行するリスクが高く、他の承認された治
療法が利用できない、軽症から中等症患
者の治療
-
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
-
-
-
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://www.fda.gov/media/155101/download
(企業側URL)
承認時~最新版添付文
書における安全性情報 -
の改定
動物実験で胎児毒性が示されており、日本では妊婦等への投与は禁忌。米国でも推奨はされないが、医療従事者による説明・同意とサーベイランスプログラムへの参加等を条件に
許可されうることがFact sheetに示されている。
2023/7/17 EUA後の副作用として、消化器系障害、嘔吐、免疫系障害、過敏症、アナフィラキシー、血管浮腫、皮膚および皮下組織障害、紅斑、そう痒症、発疹、蕁麻疹を添付文
書に記載(頻度や因果関係は不明)。
備考
2024/6/18 Fact Sheet更新
男性の場合も最後の投与日から少なくとも3か月間は避妊するよう指導する必要がある(女性の場合は日本と同じく最後の投与日から4日間)。他国(シンガポール、ニュージーラ
ンド、オーストラリア)においても男性の3か月間の避妊が推奨されている。
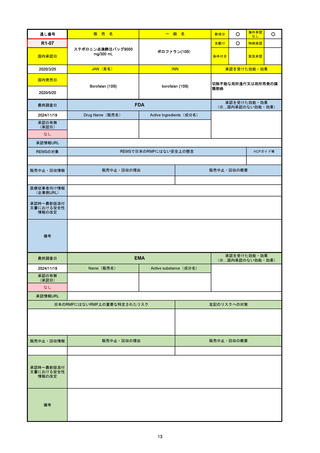
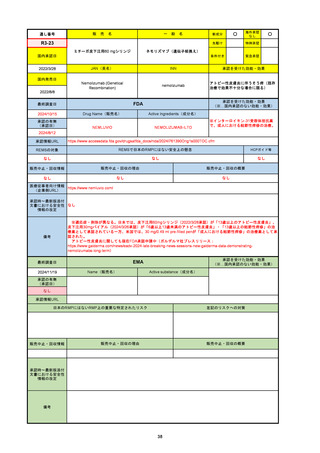
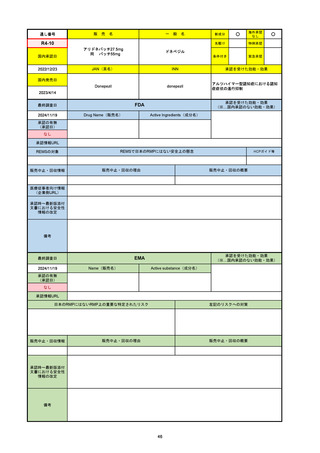
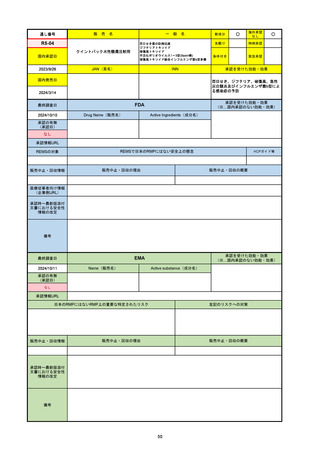
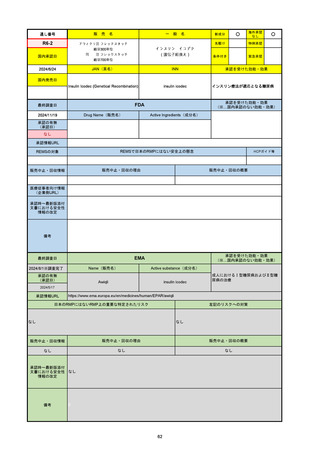
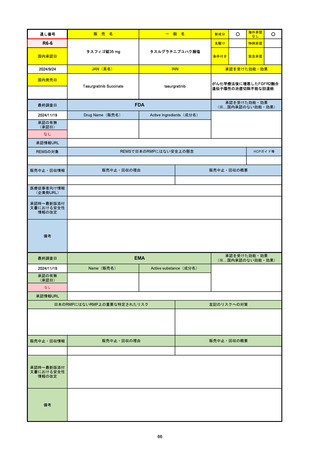
承認を受けた効能・効果
(※…国内承認のない効能・効果)
EMA
最終調査日
2024/10/10
Name(販売名)
Active substance(成分名)
Lagevrio
molnupiravir
承認の有無
(承認日)
-
2021/11/19
(緊急使用)
2023/6/21
(通常承認申請の取下
げ)
承認情報URL
https://www.ema.europa.eu/documents/referral/lagevrio-also-known-molnupiravir-mk-4482-covid-19-article-53-procedure-conditions-use-conditions_en.pdf
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
-
-
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
-
-
-
承認時~最新版添付文
書における安全性情報 -
の改定
備考
2021/10/25にRolling reviewを開始し、2021/11/19正式な申請・承認に先立って、EU加盟各国に緊急時の使用を推奨した。
2023/2/23 本剤による臨床的なベネフィットの観点から、CHMPが本申請について否定的な見解を示し、同2/24に企業側が
異議申し立てを行う意志を表明した。
再審査請求に基づき、再審査を実施していたが、2023/6/21に承認申請の取下げを行った。(緊急使用に関しては各国判断で
継続中)
33