よむ、つかう、まなぶ。
【資料3-4】医薬品等行政評価・監視委員会における海外調査(個別医薬品の欧米での承認状況)[1.2MB] (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_47693.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第18回 12/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
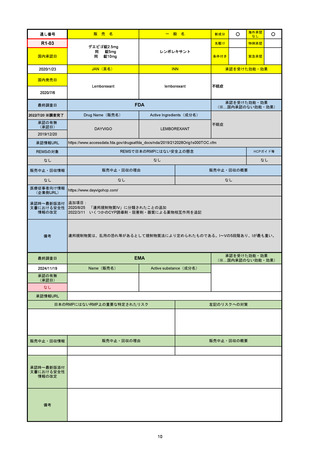
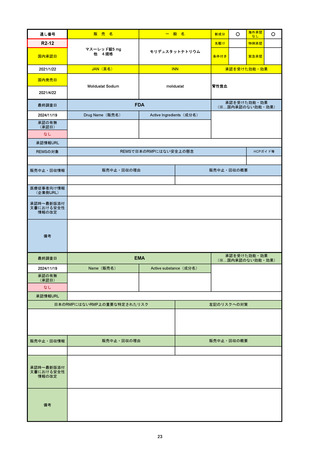
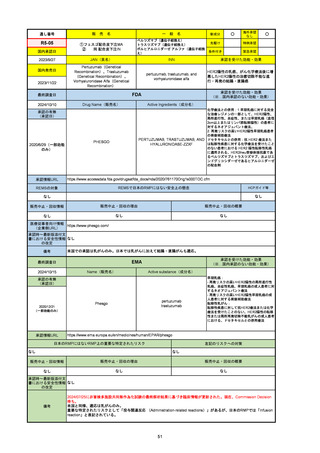
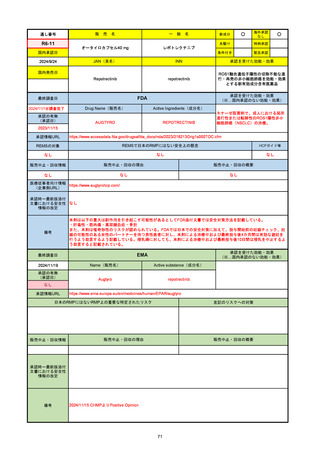
通し番号
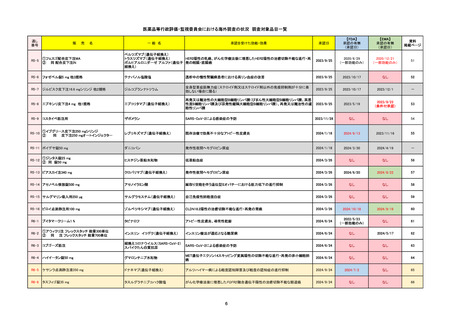
販
売
名
一
般
名
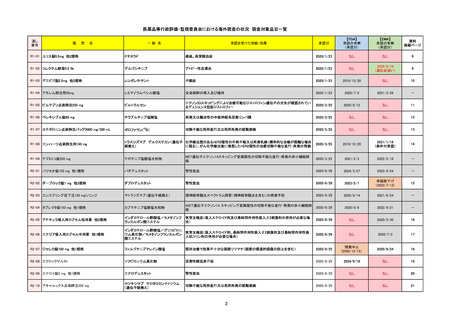
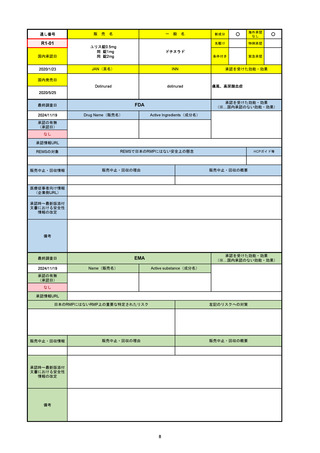
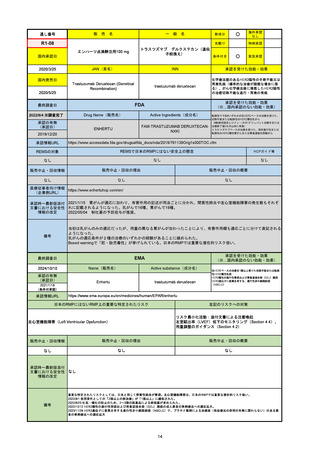
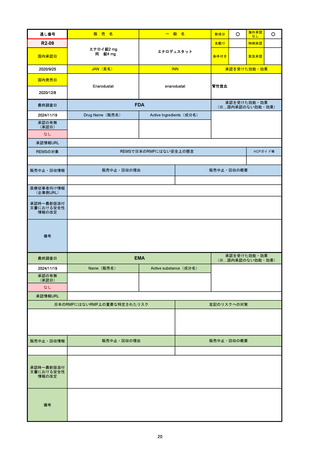
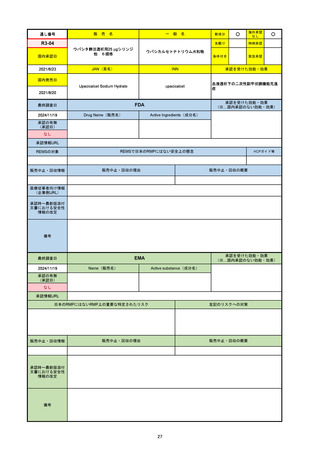
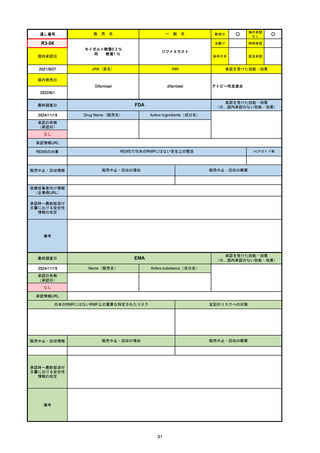
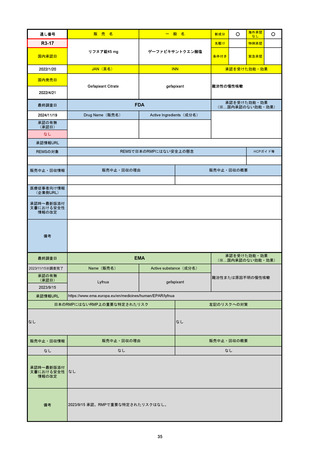
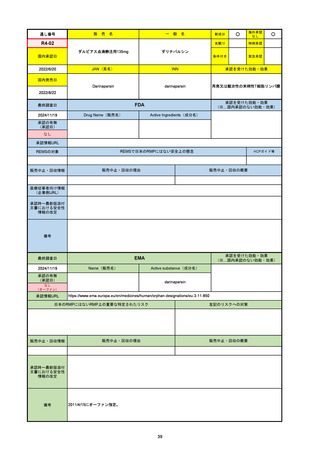
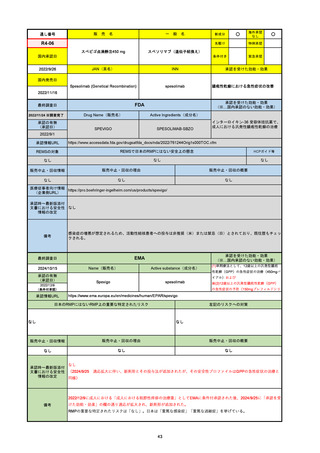
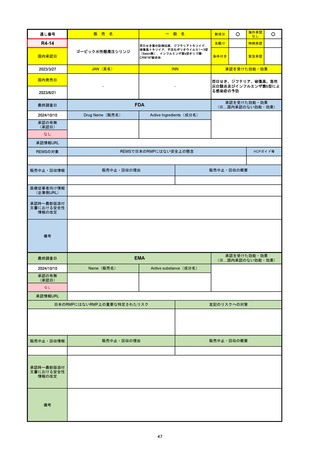
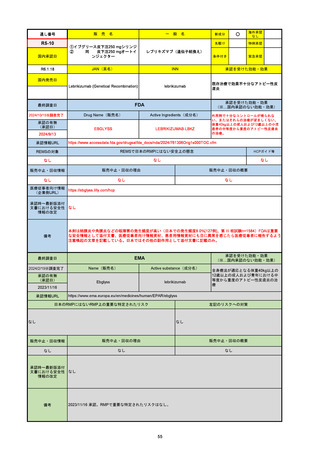
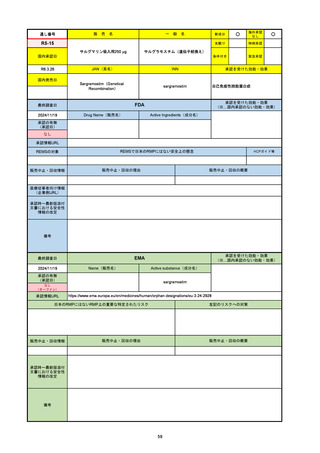
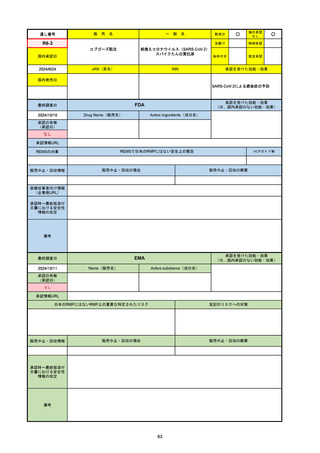
R6-9
アリッサ配合錠
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
エステトロール水和物/ドロスピレノン
国内承認日
2024/9/24
新成分
JAN(英名)
INN
Estetrol Hydrate、Drospirenone
estetrol and drospirenone
承認を受けた効能・効果
国内発売日
月経困難症
1900/1/0
2024/11/19
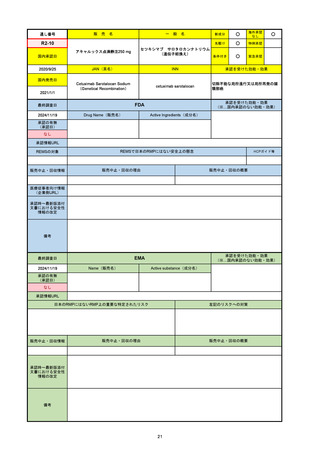
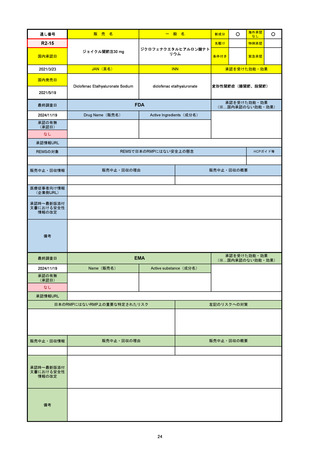
承認の有無
(承認日)
2021/4/15
(適応症違い)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
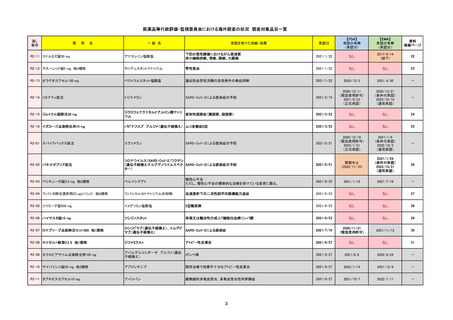
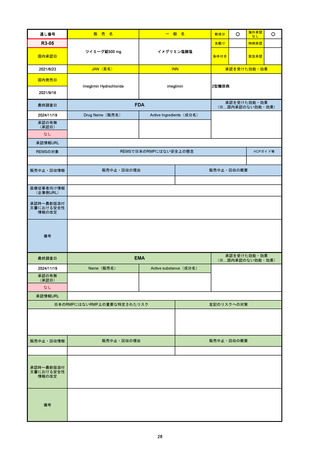
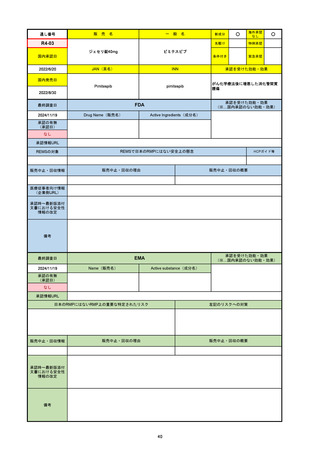
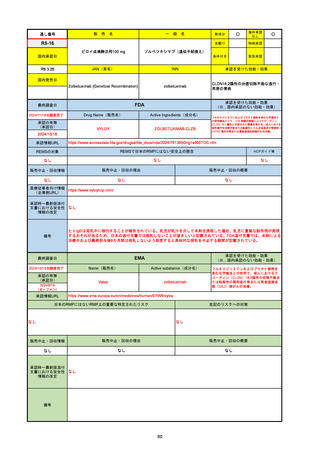
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
NEXTSTELLIS
DROSPIRENONE; ESTETROL
※エステトロール・ドロスピレノン配
合剤で、生殖可能な女性が妊娠を予防
するための経口避妊薬。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2021/214154Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
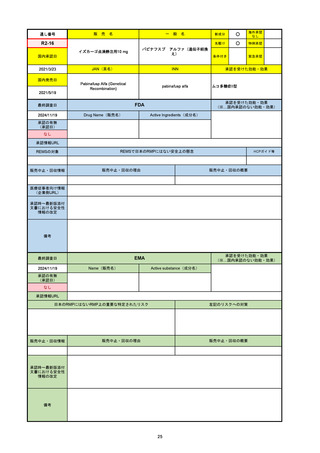
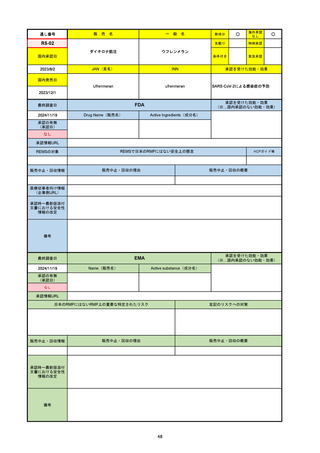
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://nextstellishcp.com/
(企業側URL)
承認時~最新版添付 追加項目:
文書における安全性 <2022/4/29>市販後調査により乳がんの発生リスクが明らかとなったため添付文書が改訂された。現在乳がんに罹患して
情報の改定
いる、または過去に乳がんに罹患したことがある女性への使用は禁忌に指定、Warningsに乳がんが追加された。
※適応症が異なる。本剤はPMDAでは月経困難症の治療薬として承認されている。
日本では35歳以上で1日15本以上喫煙する喫煙者は投与禁忌であるが、米国では本数に関わらず35歳以上の喫煙者への投与
は禁忌である。
米国の添付文書には「胆嚢疾患および胆汁うっ滞」および「肝斑」の発生リスクについて注意喚起の記載があるが、日本の
添付文書の副作用項目には記載なし。また、副作用として乳汁分泌障害が報告されているため、米国では産後の女性へ助言
するようにと記載されている。
備考
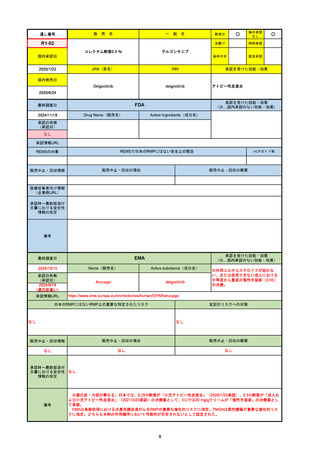
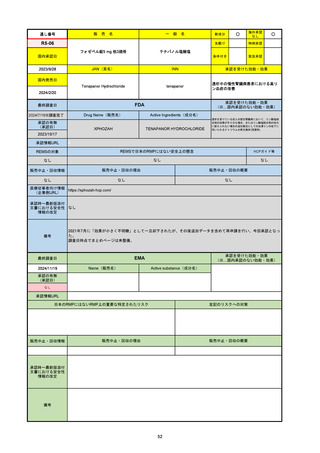
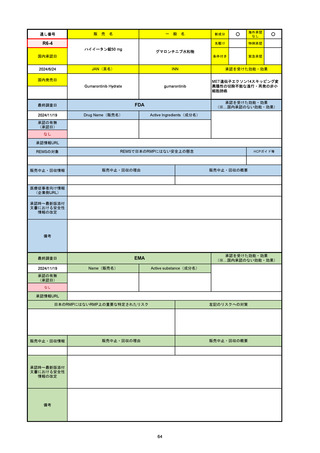
2024/10/15
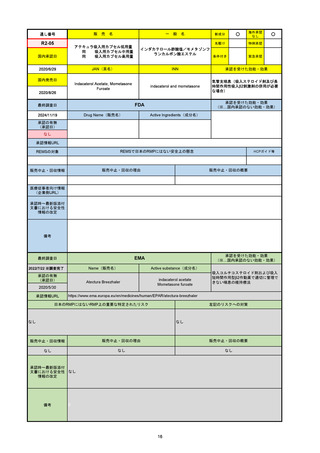
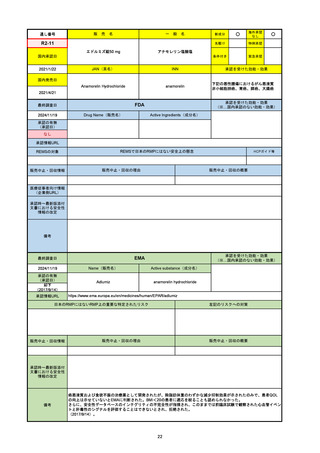
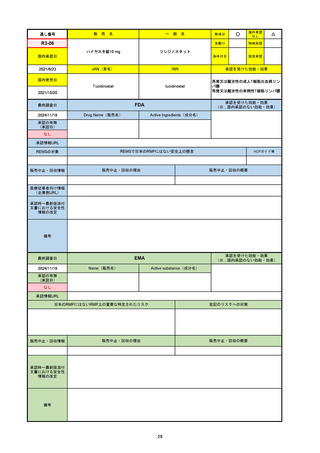
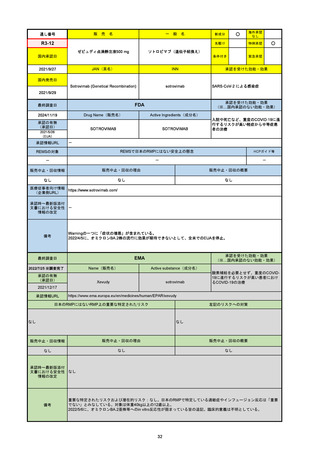
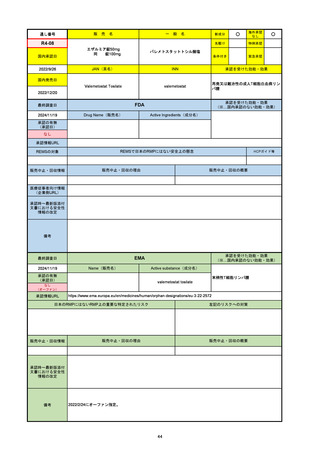
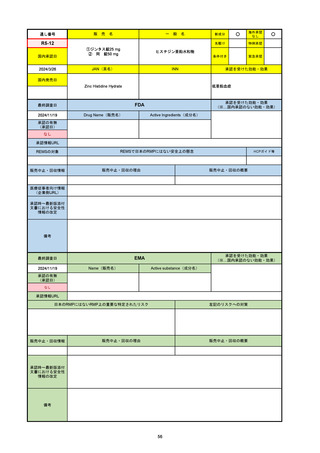
承認の有無
(承認日)
2021/5/19
(適応症違い)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
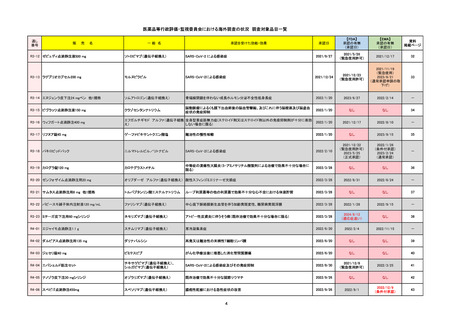
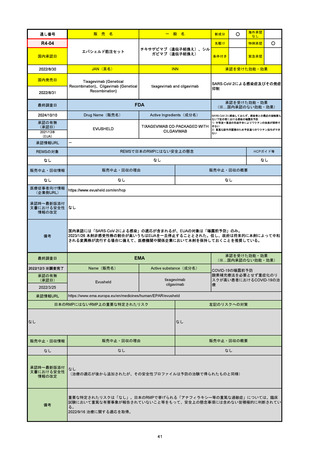
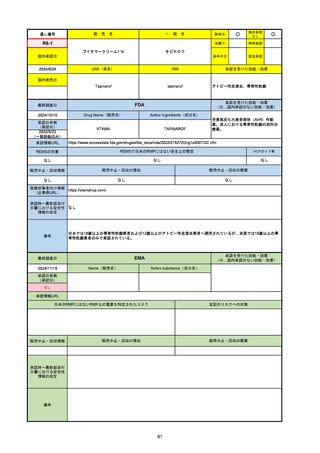
EMA
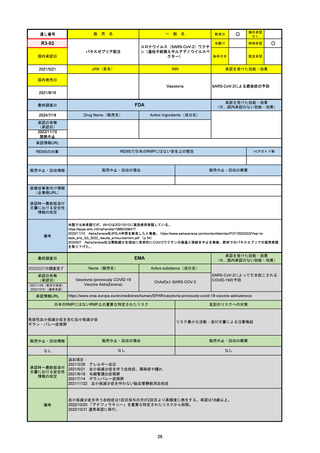
最終調査日
Name(販売名)
Active substance(成分名)
Lydisilka
estetrol monohydrate
drospirenone
経口避妊薬
https://www.ema.europa.eu/en/medicines/human/EPAR/lydisilka
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
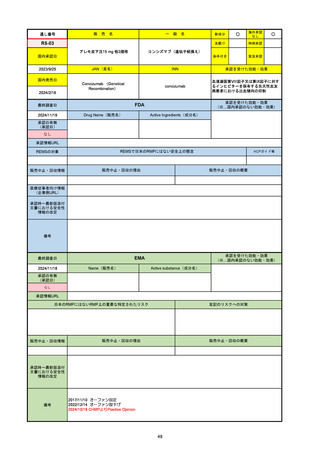
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付 追加項目:
文書における安全性
<2024/4/11>肝機能障害
情報の改定
備考
※適応症が異なる。本剤は日本では月経困難症、EUでは経口避妊薬として承認されている。
日本のRMPでは「血栓症」、EUでは「静脈血栓塞栓症(VTE)」「動脈血栓塞栓症(ATE)」がそれぞれ重要な特定され
たリスクとして設定されている。日本のRMPの中で血栓症がVTEのリスクにつながるとの記述はあるが、ATEについては
記述無し。臨床試験ではATE事象は観察されなかったが、他の経口避妊薬でも動脈血栓のリスクが確認されていることか
ら、本剤による治療中にATE事象が発生する可能性を否定できないとして、EUではRMPに設定された。
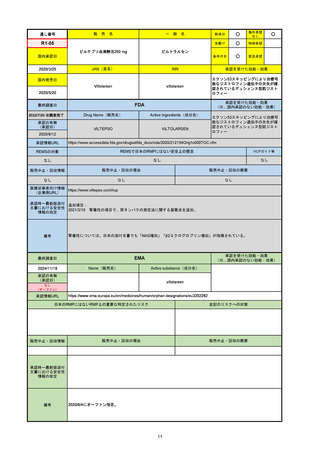
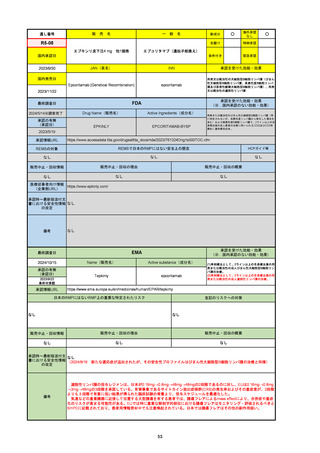
69
販
売
名
一
般
名
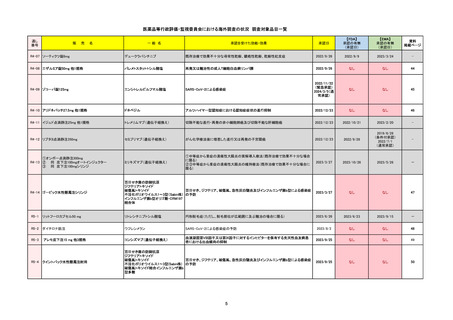
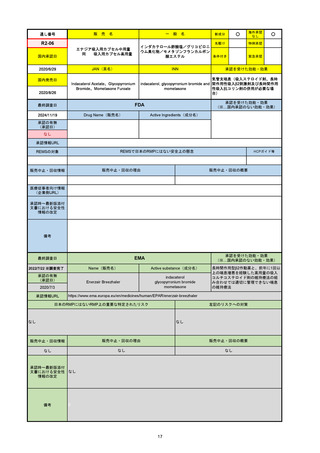
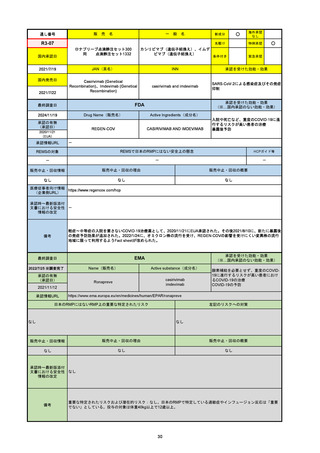
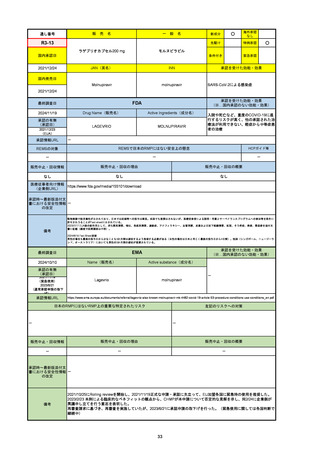
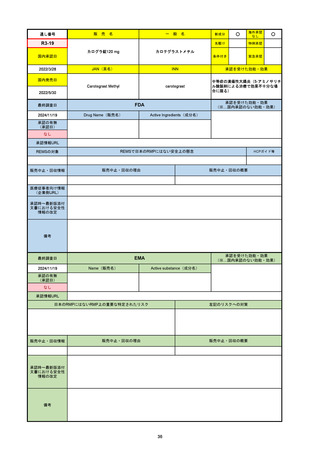
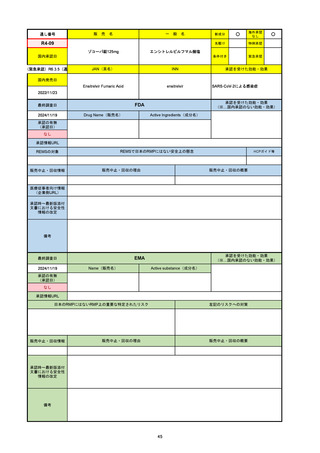
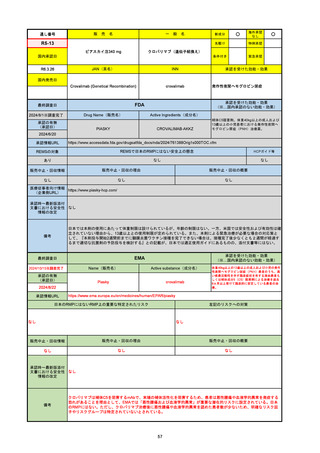
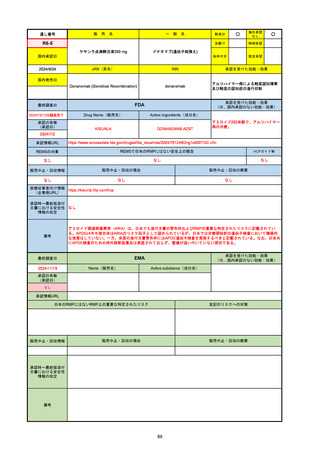
R6-9
アリッサ配合錠
○
海外承認
なし
○
先駆け
0
特例承認
0
条件付き
0
緊急承認
0
エステトロール水和物/ドロスピレノン
国内承認日
2024/9/24
新成分
JAN(英名)
INN
Estetrol Hydrate、Drospirenone
estetrol and drospirenone
承認を受けた効能・効果
国内発売日
月経困難症
1900/1/0
2024/11/19
承認の有無
(承認日)
2021/4/15
(適応症違い)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
FDA
最終調査日
Drug Name(販売名)
Active Ingredients(成分名)
NEXTSTELLIS
DROSPIRENONE; ESTETROL
※エステトロール・ドロスピレノン配
合剤で、生殖可能な女性が妊娠を予防
するための経口避妊薬。
https://www.accessdata.fda.gov/drugsatfda_docs/nda/2021/214154Orig1s000TOC.cfm
REMSの対象
REMSで日本のRMPにはない安全上の懸念
HCPガイド等
なし
なし
なし
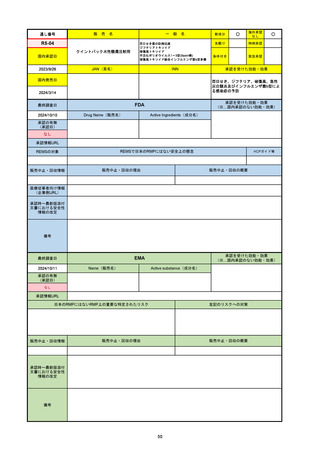
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
医療従事者向け情報
https://nextstellishcp.com/
(企業側URL)
承認時~最新版添付 追加項目:
文書における安全性 <2022/4/29>市販後調査により乳がんの発生リスクが明らかとなったため添付文書が改訂された。現在乳がんに罹患して
情報の改定
いる、または過去に乳がんに罹患したことがある女性への使用は禁忌に指定、Warningsに乳がんが追加された。
※適応症が異なる。本剤はPMDAでは月経困難症の治療薬として承認されている。
日本では35歳以上で1日15本以上喫煙する喫煙者は投与禁忌であるが、米国では本数に関わらず35歳以上の喫煙者への投与
は禁忌である。
米国の添付文書には「胆嚢疾患および胆汁うっ滞」および「肝斑」の発生リスクについて注意喚起の記載があるが、日本の
添付文書の副作用項目には記載なし。また、副作用として乳汁分泌障害が報告されているため、米国では産後の女性へ助言
するようにと記載されている。
備考
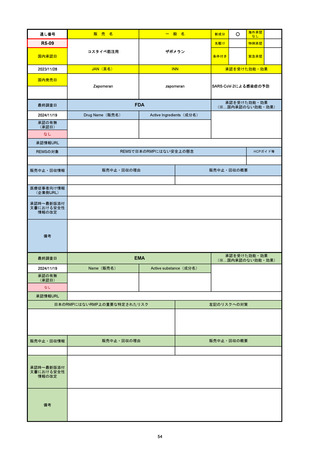
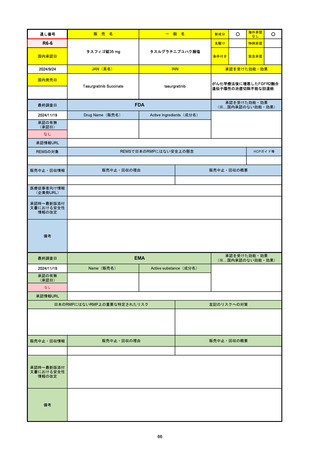
2024/10/15
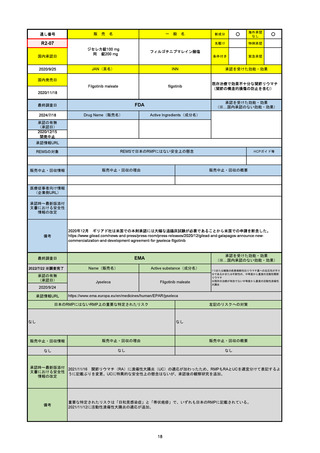
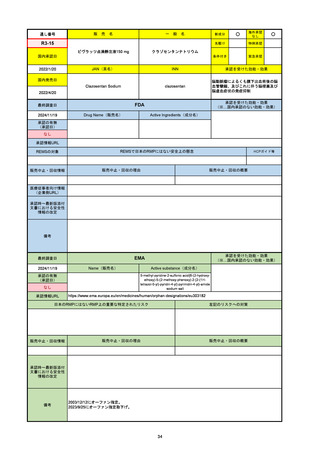
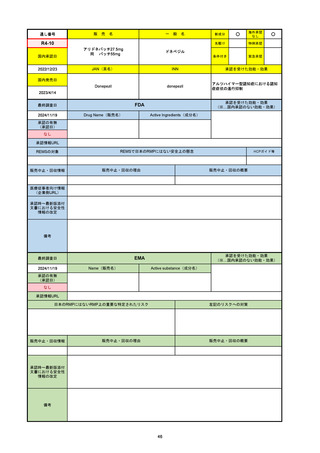
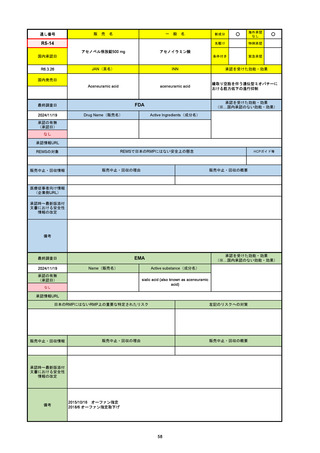
承認の有無
(承認日)
2021/5/19
(適応症違い)
承認情報URL
承認を受けた効能・効果
(※…国内承認のない効能・効果)
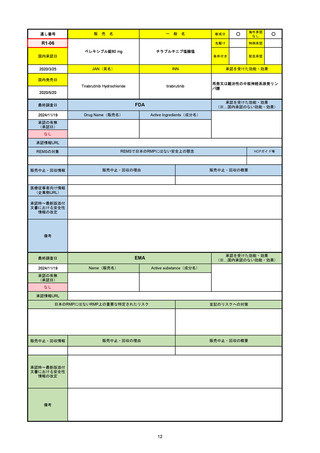
EMA
最終調査日
Name(販売名)
Active substance(成分名)
Lydisilka
estetrol monohydrate
drospirenone
経口避妊薬
https://www.ema.europa.eu/en/medicines/human/EPAR/lydisilka
日本のRMPにはないRMP上の重要な特定されたリスク
左記のリスクへの対策
なし
なし
販売中止・回収情報
販売中止・回収の理由
販売中止・回収の概要
なし
なし
なし
承認時~最新版添付 追加項目:
文書における安全性
<2024/4/11>肝機能障害
情報の改定
備考
※適応症が異なる。本剤は日本では月経困難症、EUでは経口避妊薬として承認されている。
日本のRMPでは「血栓症」、EUでは「静脈血栓塞栓症(VTE)」「動脈血栓塞栓症(ATE)」がそれぞれ重要な特定され
たリスクとして設定されている。日本のRMPの中で血栓症がVTEのリスクにつながるとの記述はあるが、ATEについては
記述無し。臨床試験ではATE事象は観察されなかったが、他の経口避妊薬でも動脈血栓のリスクが確認されていることか
ら、本剤による治療中にATE事象が発生する可能性を否定できないとして、EUではRMPに設定された。
69