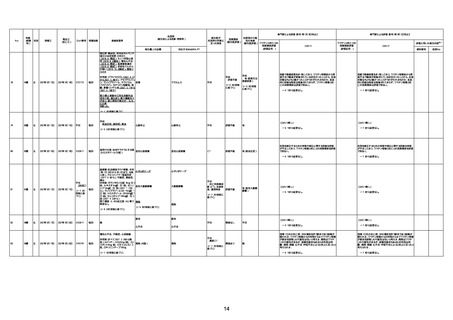
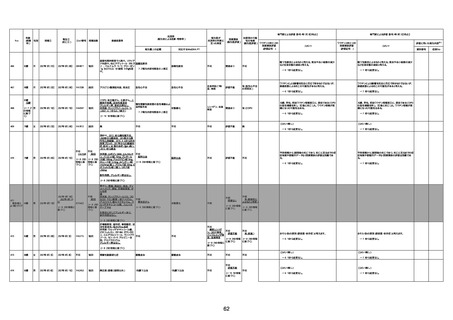
資料1-3-1 新型コロナワクチン接種後の死亡として報告された事例の概要(コミナティ筋注) (256 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
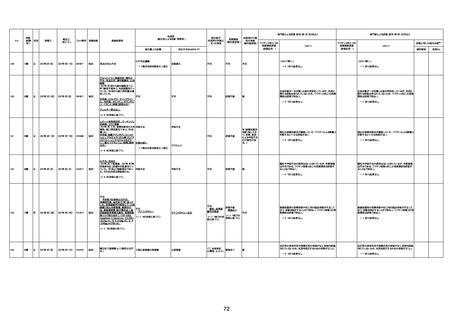
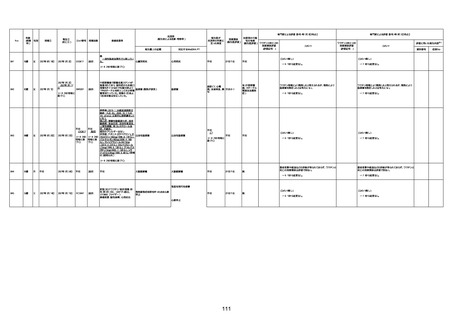
年齢
(接種
時)
性別
接種日
発生日
(死亡日)
ロット番号
接種回数
死因等
(報告者による見解・考察等)
基礎疾患等
報告書上の記載
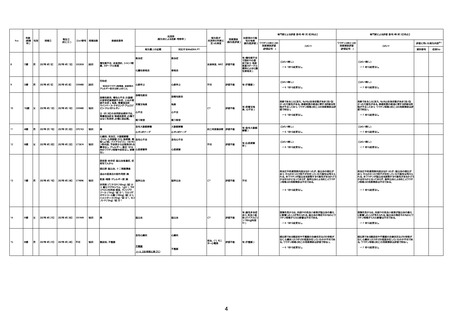
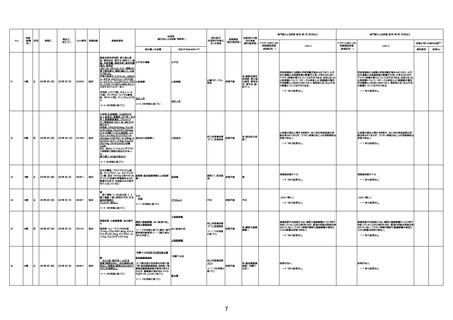
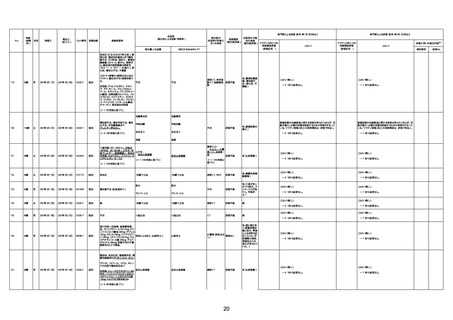
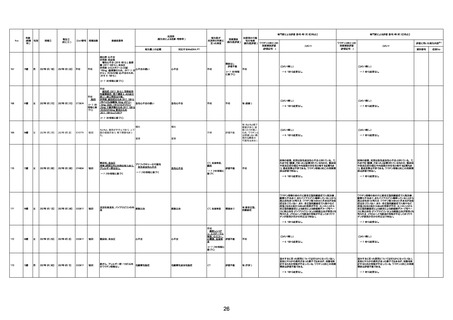
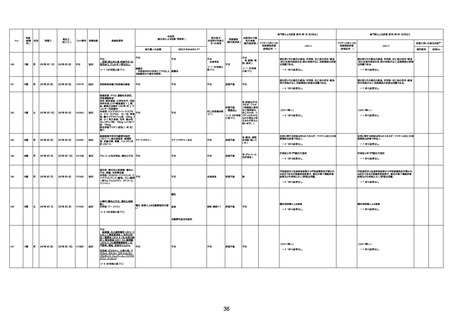
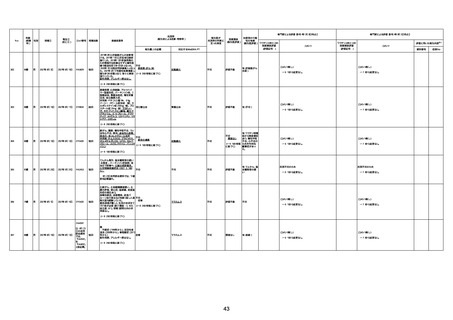
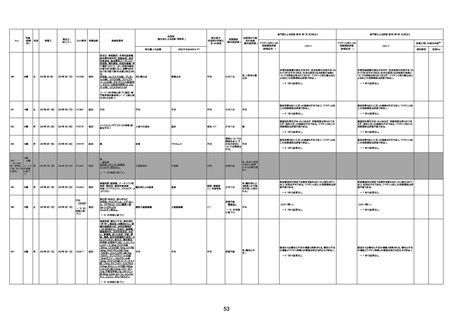
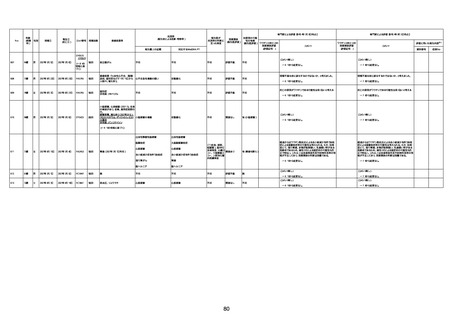
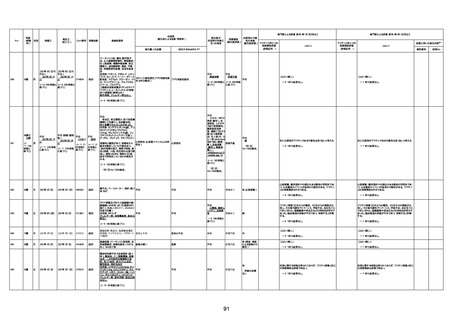
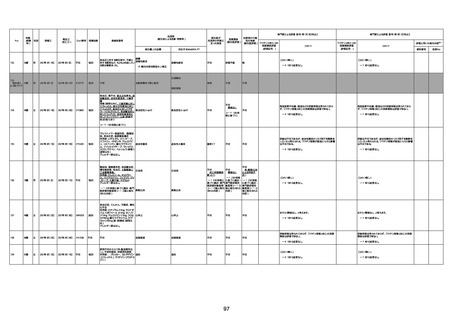
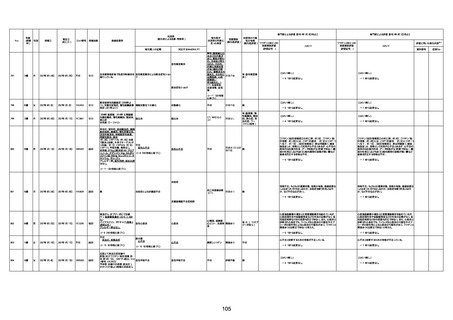
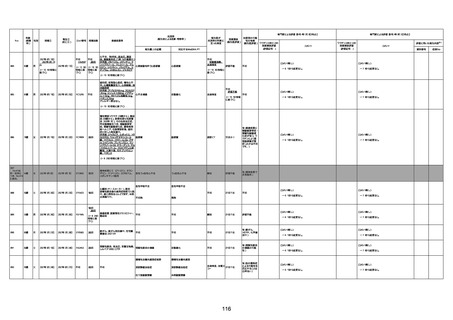
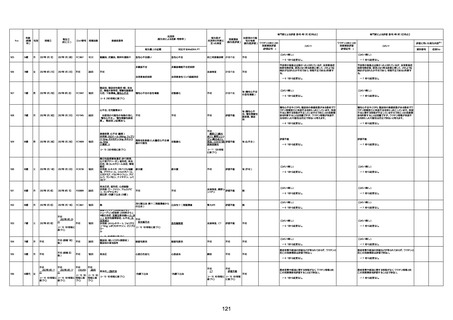
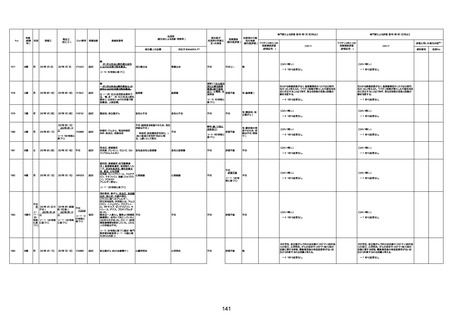
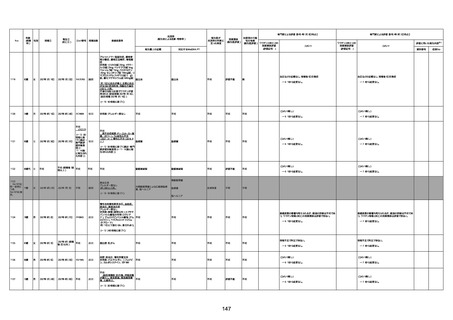
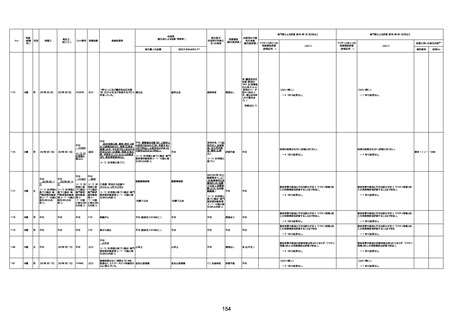
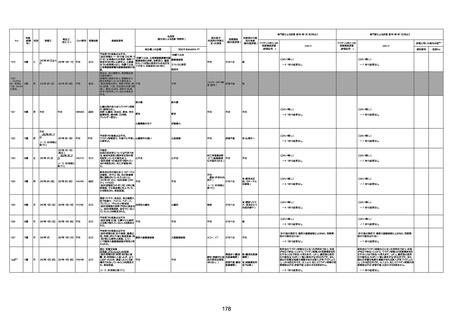
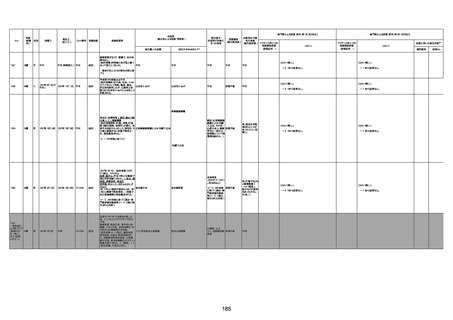
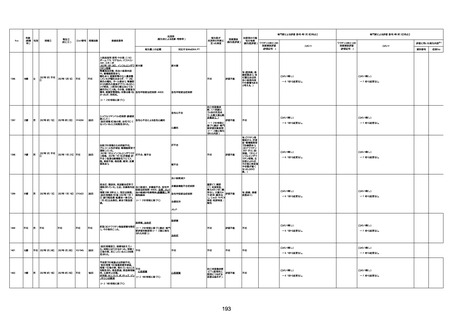
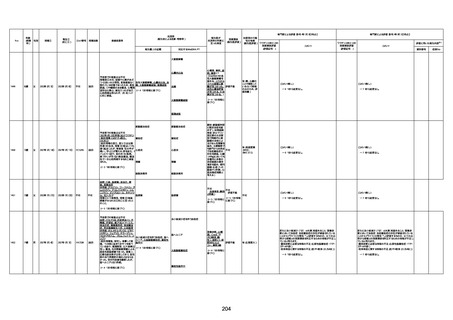
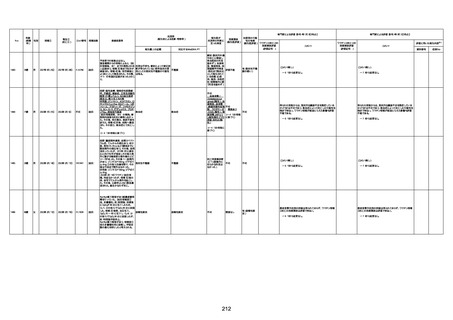
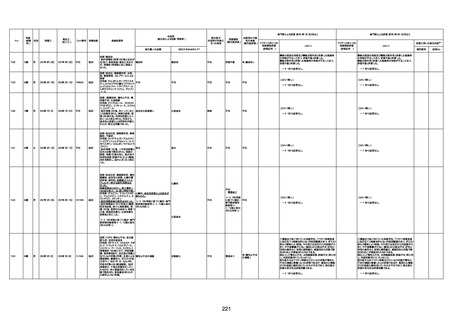
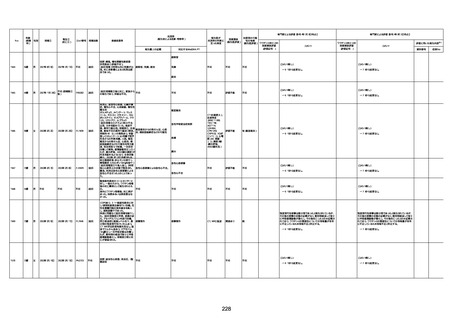
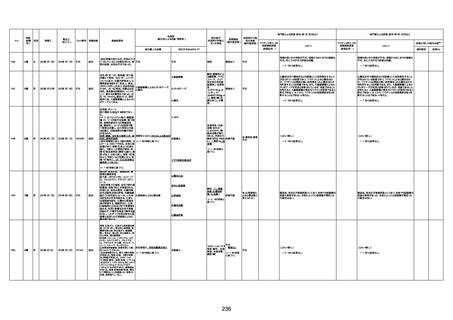
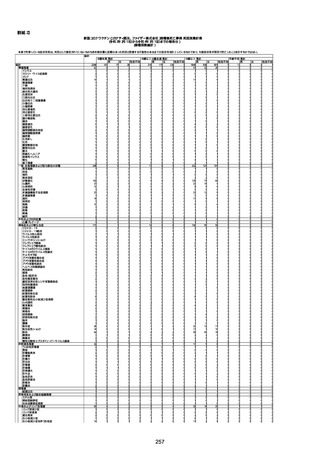
1673
96歳
女
2022年7月12日
2022年7月14日
FT8584
専門家による評価【令和4年7月8日時点】
報告医が
死因等の判断に
至った検査
因果関係
(報告医評価)
他要因の可能
性の有無
(報告医評価)
対応するMedDRA PT
ワクチンと死亡との
因果関係評価
★
(評価記号 )
コメント
専門家による評価【令和4年8月5日時点】
ワクチンと死亡との
因果関係評価
★
(評価記号 )
コメント
評価に用いた報告内容
資料番号
症例No
4回目
併用薬:バイアスピリン
副作用歴:アダラート、クラリスでむ
くみ
2022年1月29日コミナティ3回目接
種。3回目接種後には特に副反応な
虚血性心疾患
く特段変わったことはなかったと家
族からの報告。
ワクチン4回目接種後翌日は通常ど
おりで変わった様子はなく、接種2日
後に突然死。
評価中
検視
評価不能
有(虚血性心疾
患)
-
-
-
評価中
-
-
評価中
不明
関連あり
無
-
-
-
評価中
-
-
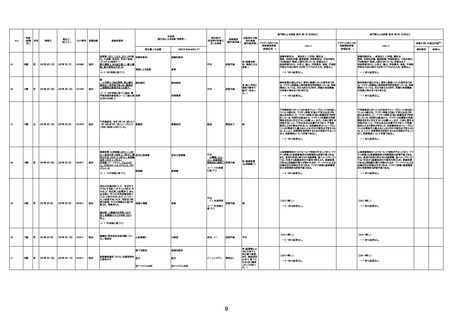
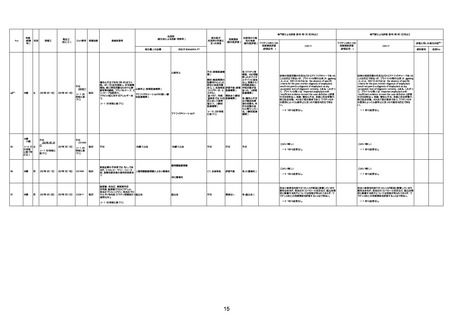
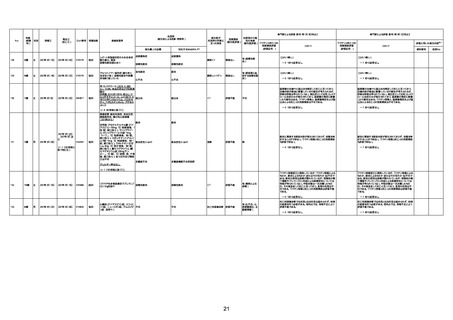
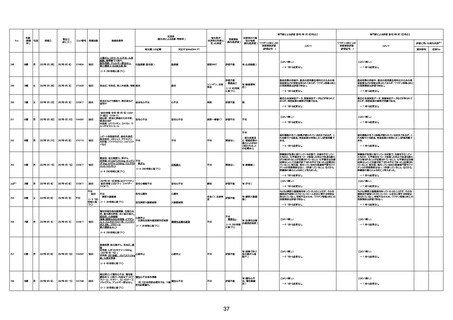
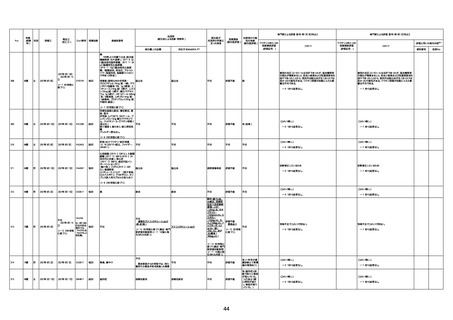
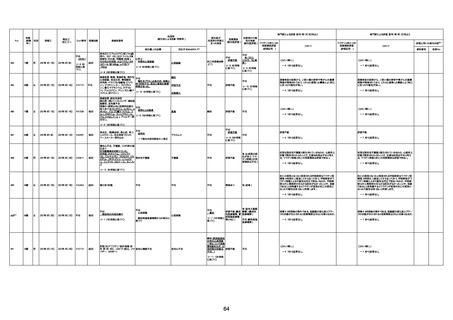
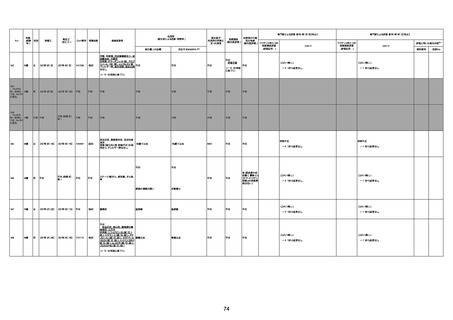
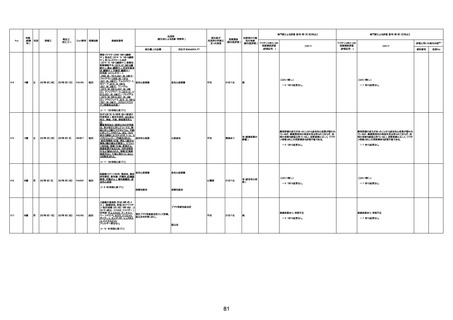
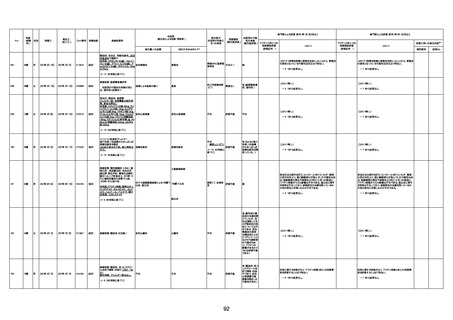
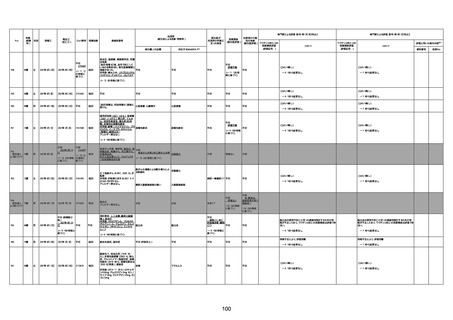
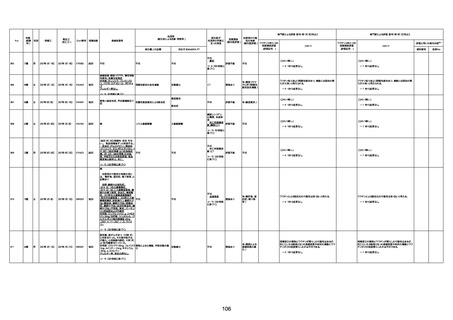
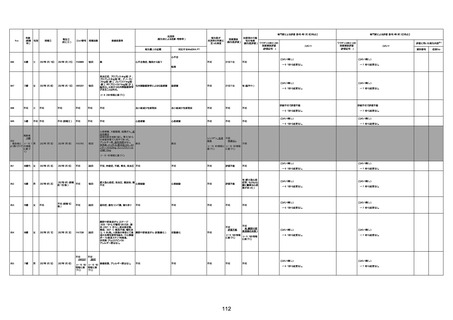
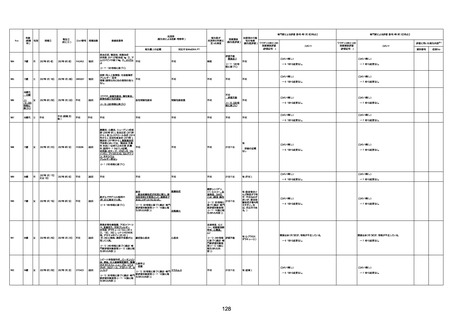
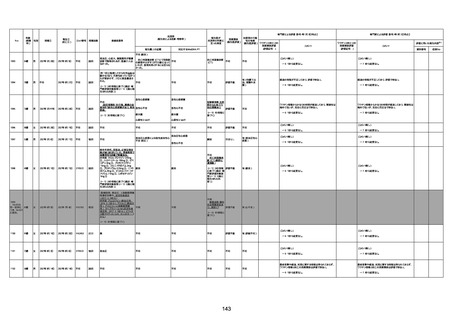
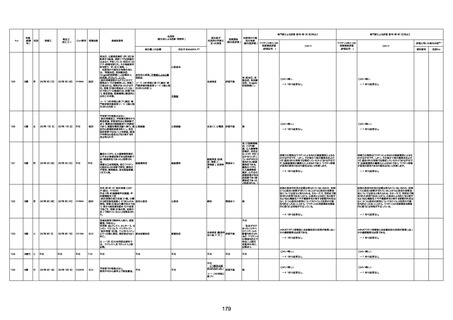
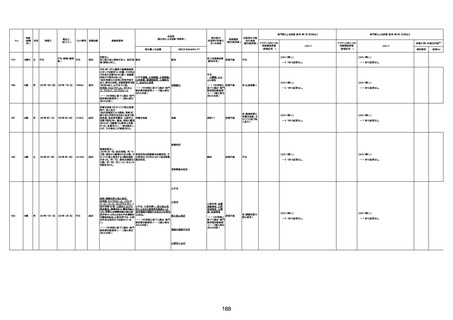
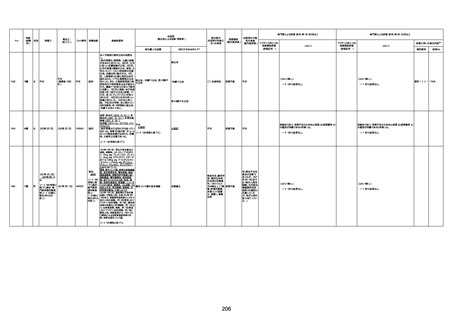
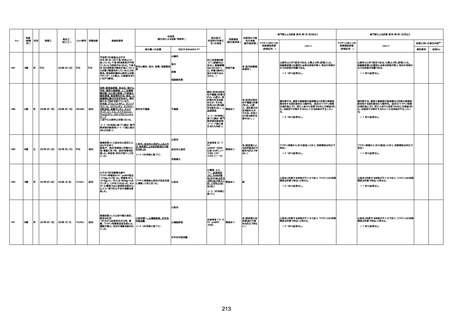
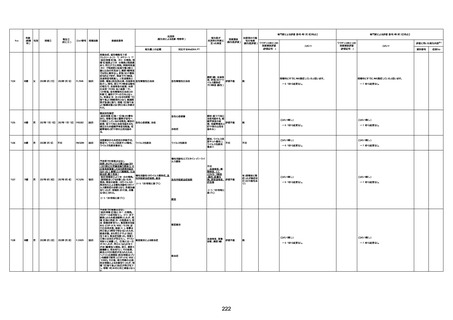
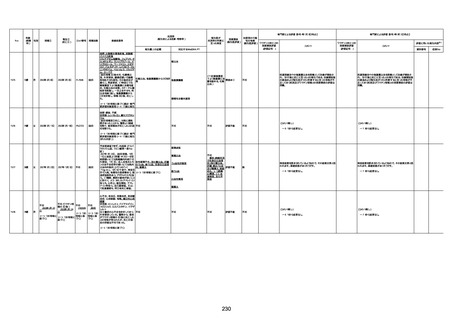
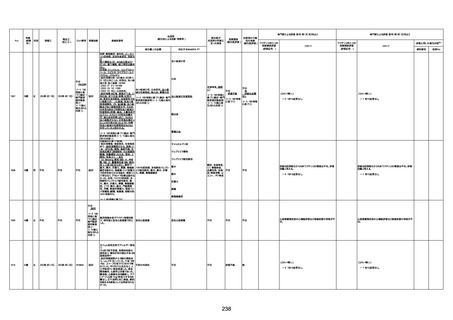
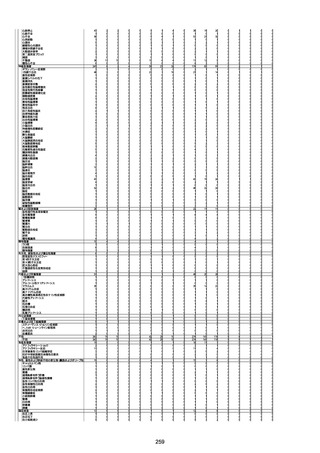
1674
78歳
男
2022年6月26日
2022年7月13日
FK0108
4回目
病歴:糖尿病、統合失調症
併用薬:ジャヌビア、シメチジン、ゾ
ピクロン、クアゼパム、リスパダール
アレルギー歴なし
ワクチン4回目接種の1日後から発
熱あり。接種2日後からSpO2 80%台 間質性肺炎
に低下。接種5日後にはSpO2 60%
台となり、救急搬送。間質性肺炎の
診断で入院。入院後、ステロイド治
療を開始。しかし呼吸不全がさらに
悪化し、接種17日後の夜に死亡。
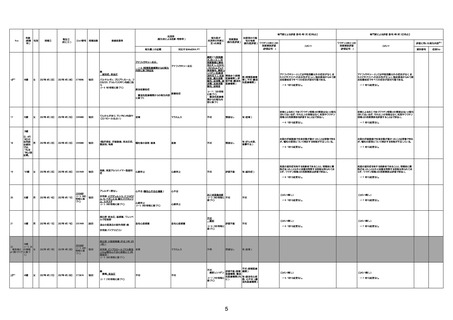
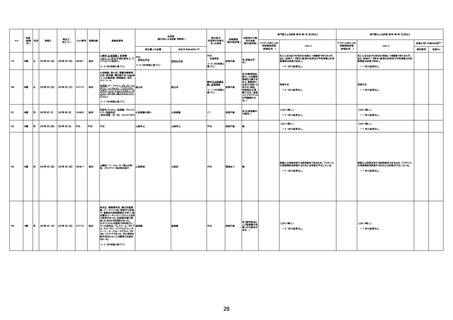
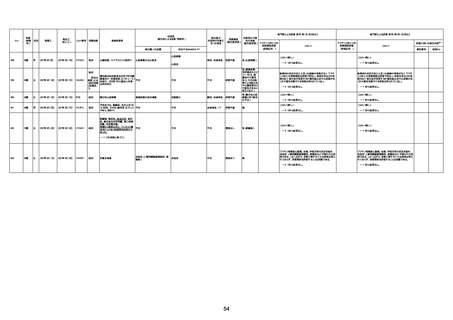
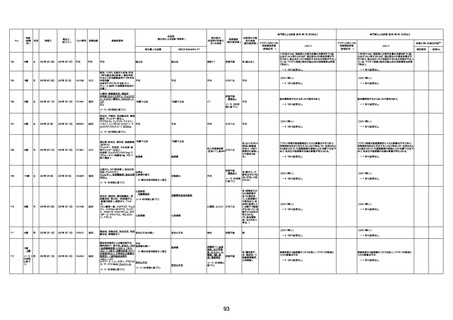
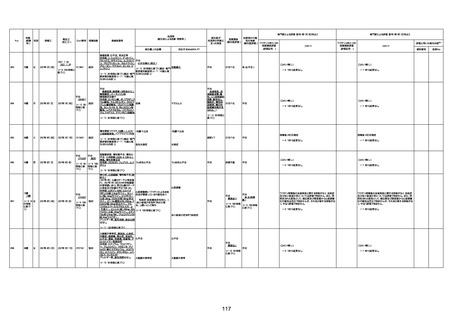
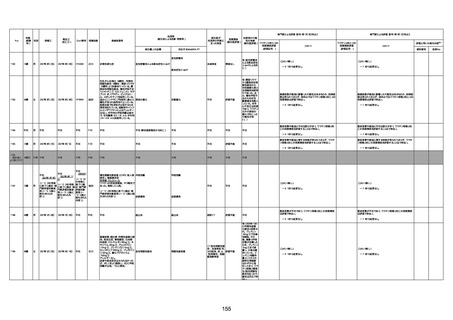
1675
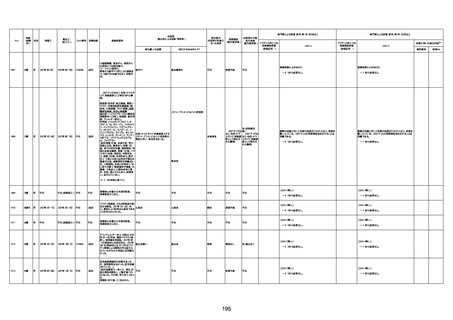
71歳
男
2022年7月1日
2022年7月13日
不明
4回目
基礎疾患不明、服用薬剤なし
脳出血
評価中
不明
不明
不明
-
-
-
評価中
-
-
評価中
不明
評価不能
有(糖尿病性腎
症、ARDS)
-
-
-
評価中
-
-
評価中
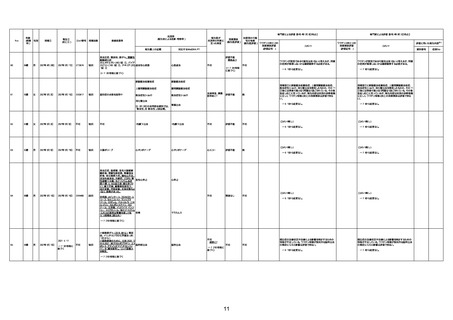
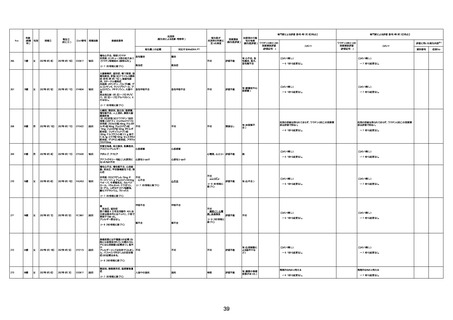
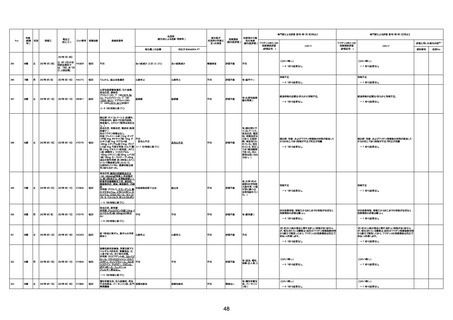
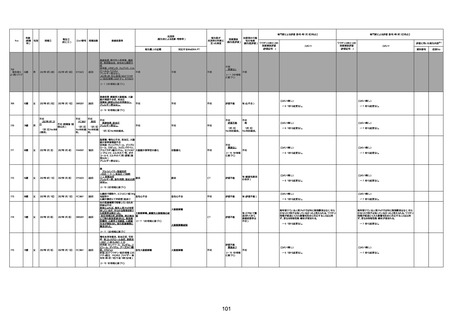
不明
不明
不明
-
-
-
評価中
-
-
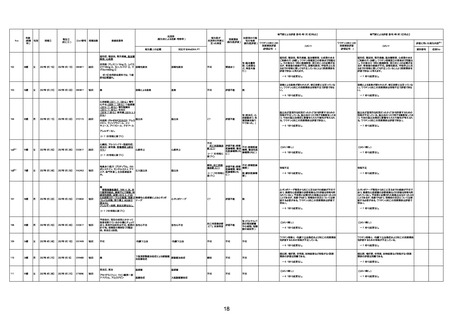
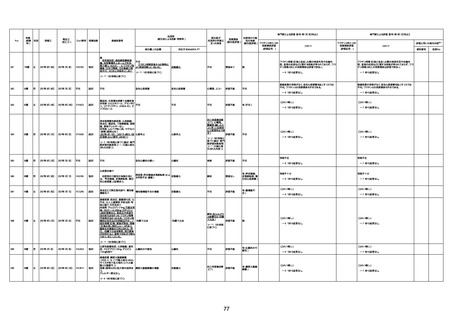
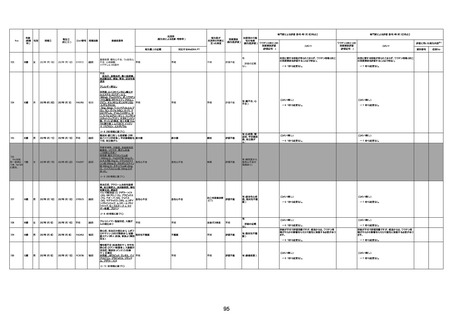
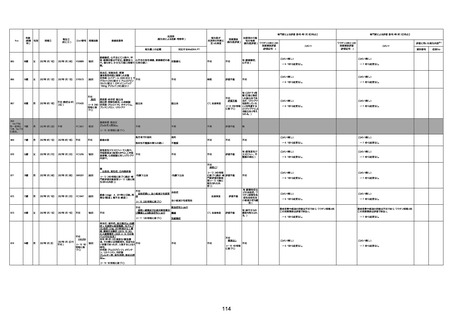
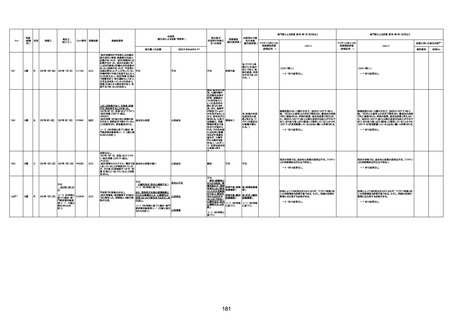
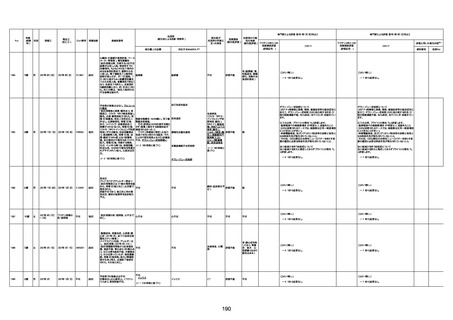
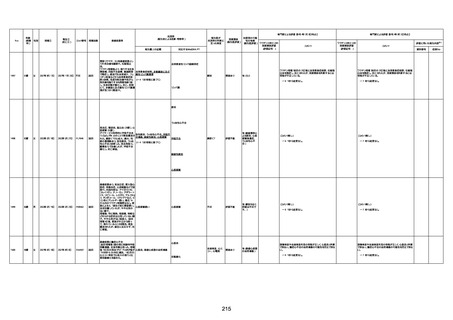
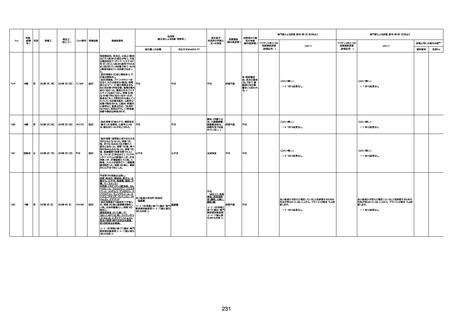
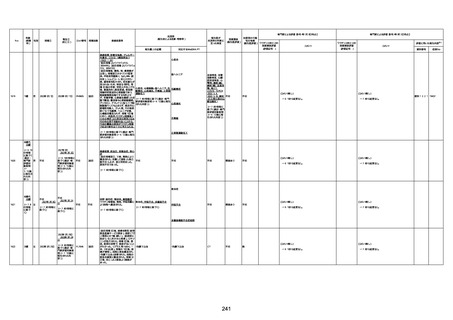
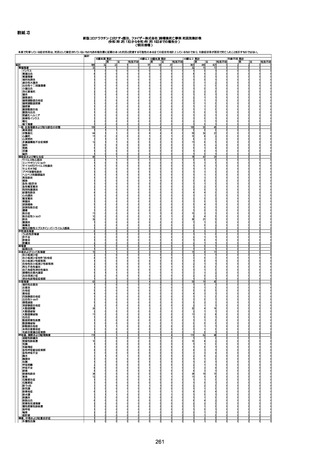
1676
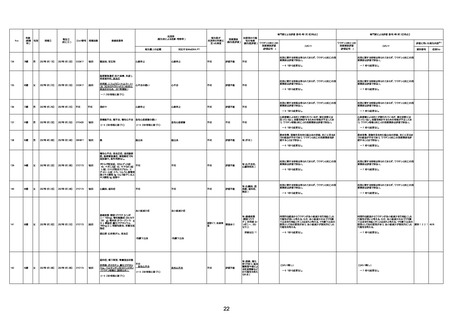
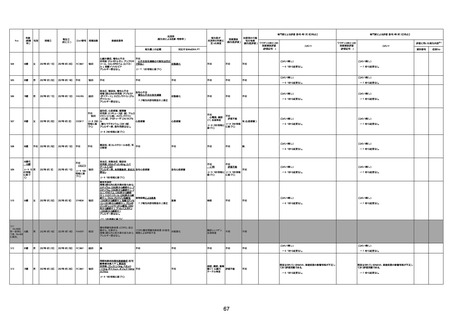
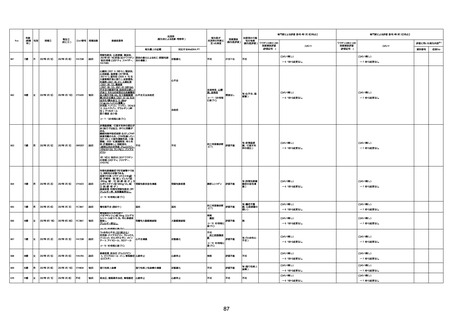
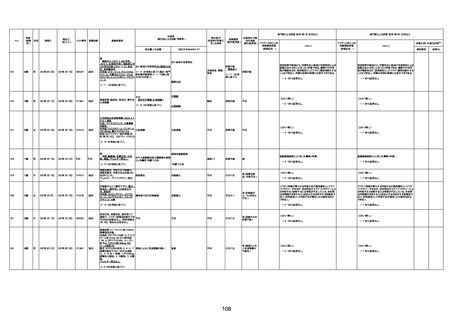
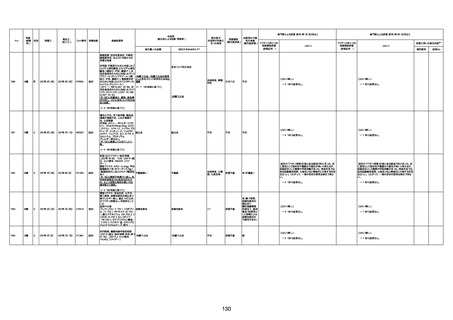
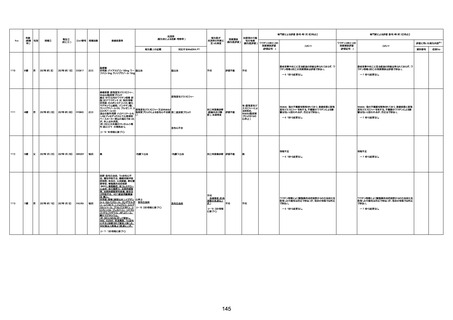
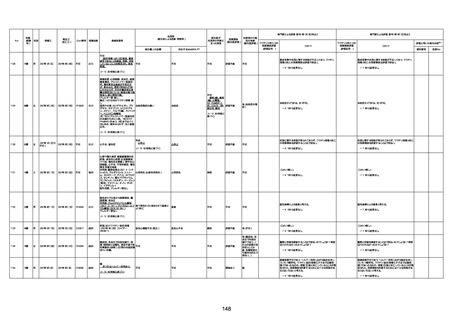
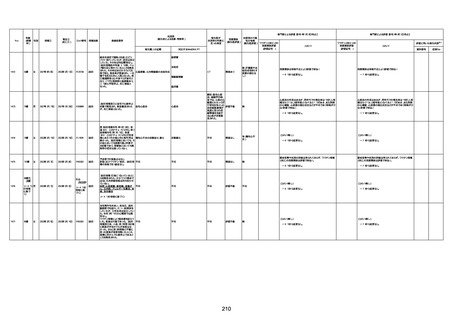
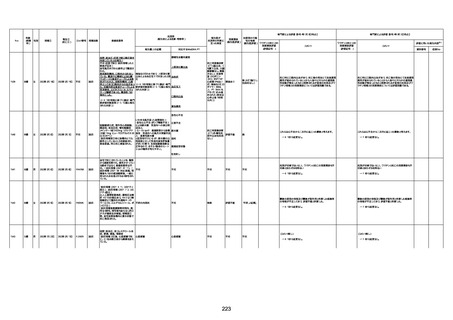
74歳
男
2021年6月29日
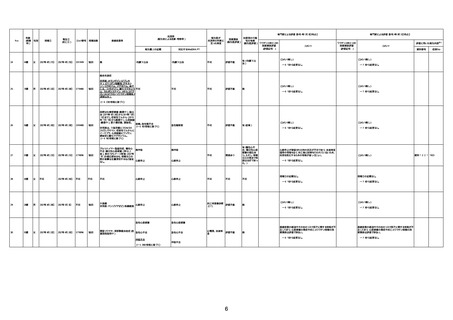
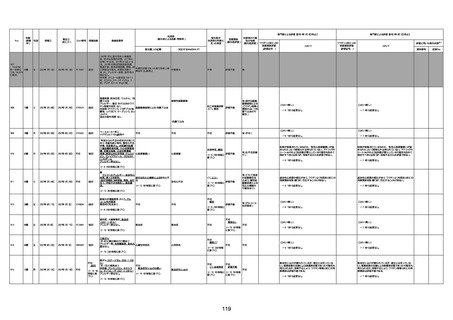
1677
64歳
不明 不明
2021年7月6日
FC3661
2回目
基礎疾患:糖尿病(内服治療するも
コントロール不良であり、HbAlc13
台。腎不全も徐々に進行しクレアチ
ニン値2.5)
ワクチン接種の3ヶ月前にARDSと考
えられる両側肺炎を発症し、約2ヶ
月入院。インスリン治療によりHbAlc
7台、肺炎も治癒し退院。
外来にて2回目の接種、翌日に肺水
腎不全
腫及び心不全の増悪を発症し同日
入院。
HbAlcは6.15と良好であった。接種
翌日のクレアチニン値3.47と不良、
中心静脈栄養および利尿剤にて心
不全の治療を行うも、クレアチニン
値は接種4日後に5.34、接種6日後
には7.37と急速に増悪し、併せて心
不全も憎悪。接種7日後に死亡。
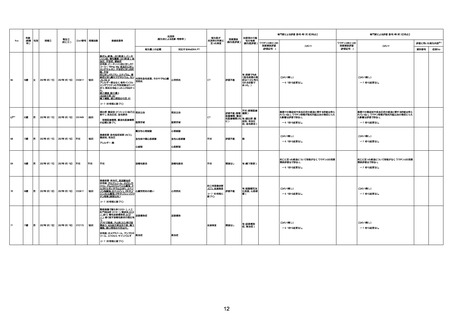
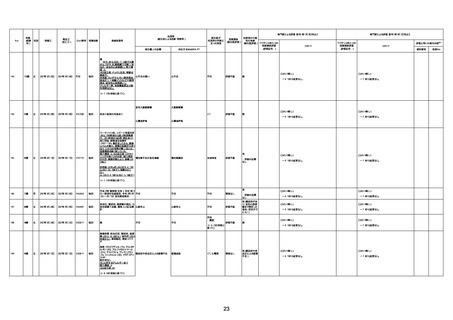
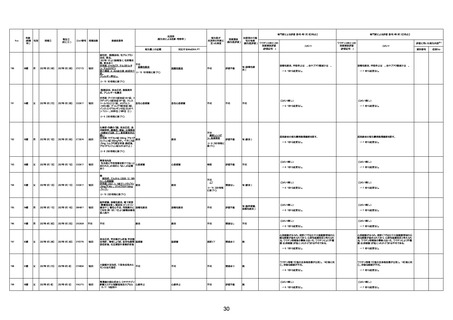
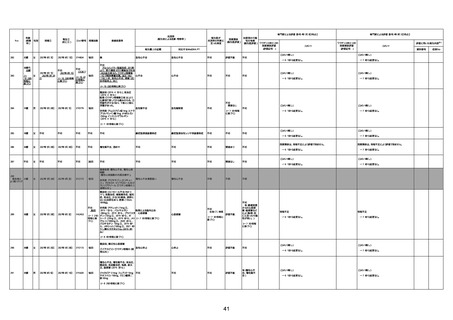
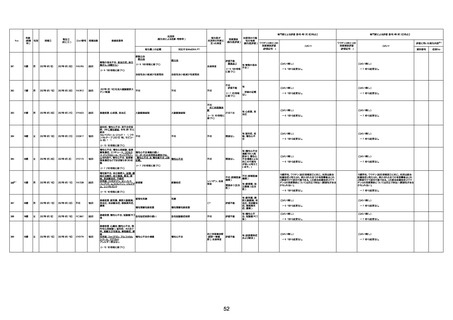
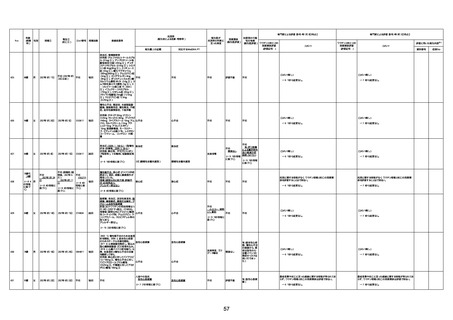
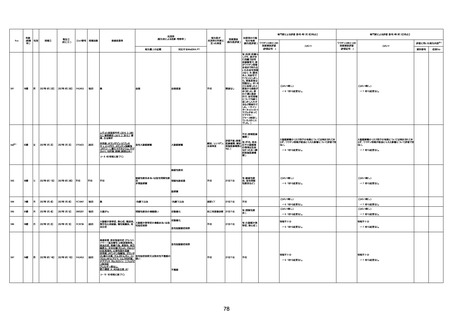
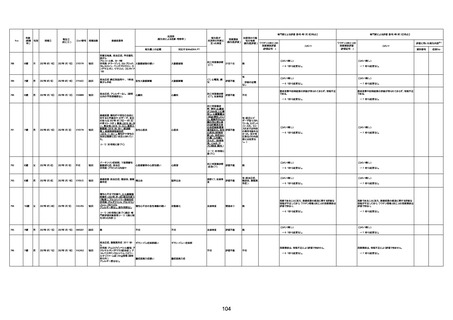
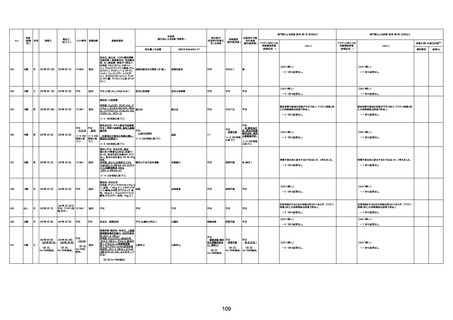
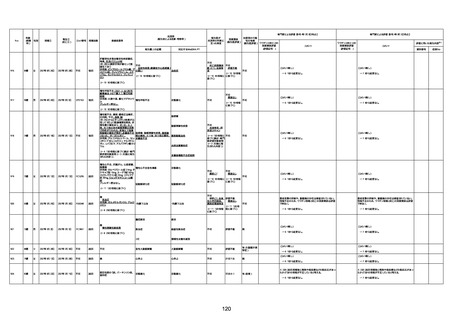
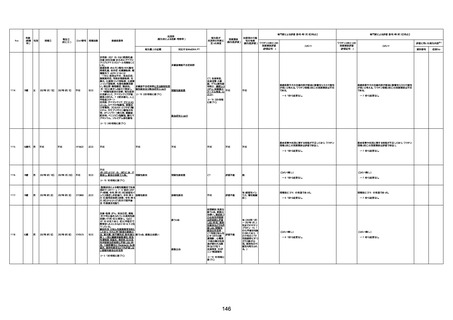
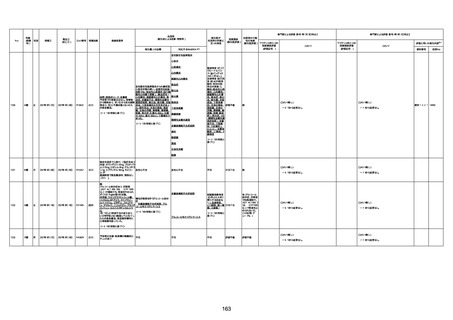
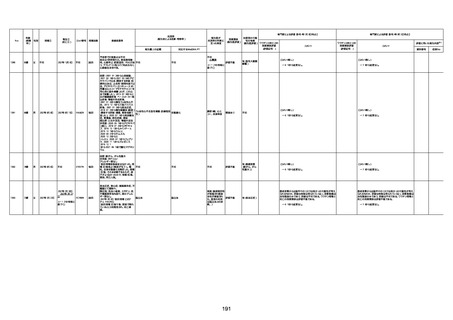
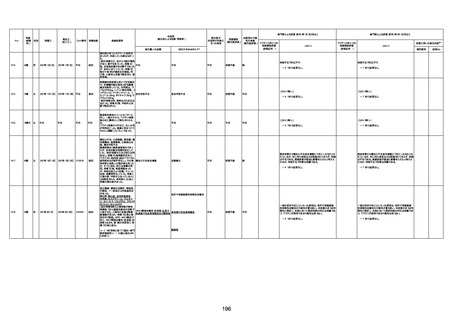
不明
不明
1回目
1回目は施設に出向き接種した。3
週間後に2回目接種のため施設を
不明
訪問した際、不在だったため確認す
ると死亡されたことがわかった。
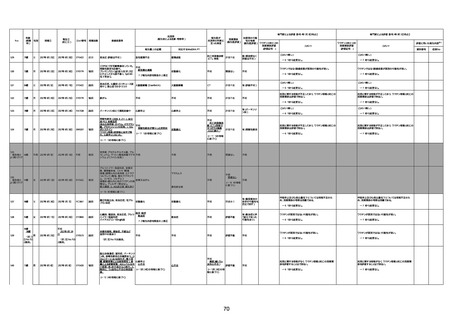
注2
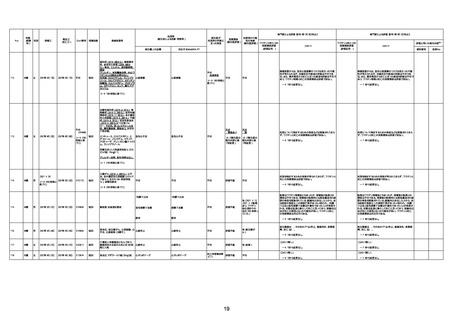
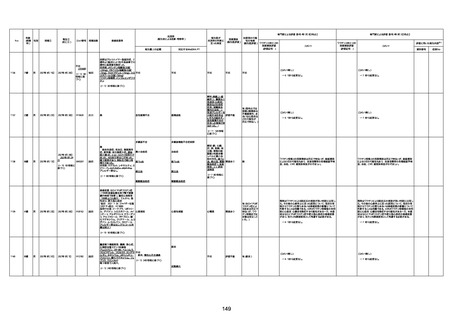
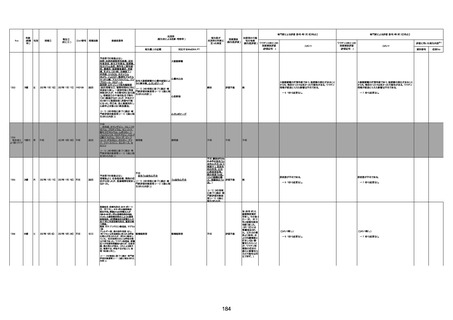
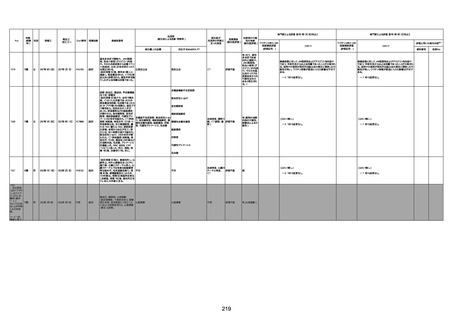
注1:各症例の記載は、令和3年2月17日〜令和4年6月24日までに、医療機関又は本ワクチンの製造販売業者から副反応疑い報告された内容に基づく。専門家による評価は、特記した場合を除き、令和4年6月12日時点の報告内容に基づき実施。
注2:直近の集計対象期間において新規又は追加報告された症例について、対応する症例Noを記入している。同一症例であっても、報告内容の更新等により医療機関又は製造販売業者から複数回報告される場合がある。同一症例について複数回報告された場合は、評価時点で最後に報告された報告内容に基づき評価している。
注3:2021年3月30日に製造販売業者から厚生労働省に一報。詳細調査の後、4月6日に副反応疑い報告がなされた。
注4:接種医療機関及び搬送先医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注5:接種医療機関及び解剖実施医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注6:接種医療機関及び検視医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注7:接種医療機関及び主治医から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注8:搬送先医療機関及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注9:主治医及び解剖医療機関から同一事例について報告あり。本表の記載内容は、両報告内容に基づく。
注10:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
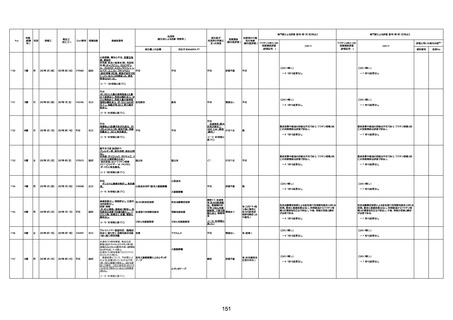
注11:入院時検査にて、抗CCP抗体高値陽性(142.0U/ml)、RF高値陽性(87IU/ml)、MMP3(111.5ng/ml)であり、関節リウマチに合致する所見を認めた。抗TNF製剤で抗核抗体や抗dsDNA抗体が陽転化する報告があるが、いずれも陰性で、他、抗RNP抗体陰性、抗Sm抗体陰性、抗リン脂質抗体(ループスアンチコアグラント、抗カルジオリピンIgG抗体、抗カルジオリピンβ2GP1抗体)は全て陰性であり、C3 70mg/dl、C4 18mg/dl、CH50 55.0U/mlと
ほぼ正常範囲でSLE合併などによる血小板減少は考えにくい。IgG 1547mg/dl、IgA 693mg/dl、IgM 70mg/dlであった。ヘパリン使用歴はなく、HIT抗体は陰性であった。PA-IgGが206.0ng/10^7cells(基準値46ng/10^7cells以下)で、血小板表面に結合しているIgG(抗血小板抗体)を多数認めた。自己抗体の中で関節リウマチに関連したもの以外で入院以前に異常値を認めたものはないか、測定記録無しであった。本例ではPA-IgGが206.0ng/10^7cells
で、血小板表面に結合しているIgG(抗血小板抗体)を多数認めた。長期間安定していた関節リウマチ患者に発生した突然の血小板減少の誘因として、以下考察する。抗血小板抗体は時に関節リウマチで陽転化する場合があるが、免疫グロブリンはいずれもポリクローナルな増加は見られず、関節リウマチの活動性も高くないことを踏まえれば、関節リウマチ自体により体内で抗血小板抗体が陽転化する可能性は低かったと考える。次に、本患者に
使用されていた注射剤(シンポニー(ゴリムマブ)及びミルセラ(エポエチンベータペゴル))においては、両薬剤ともに、頻度不明ながらも血小板減少が報告されている。両薬剤によって血小板減少を誘発した可能性は否定できないが、それが抗血小板抗体による機序であるかどうか不明であり、長期間安全に使用されてきた経緯を踏まえれば、両薬剤によって血小板減少が引き起こされた可能性は低いものと考える。引き続き症例の蓄積が必要で
あり、早急な判断はできないが、本例はワクチンの2回目投与直後のタイミングであり、ワクチンによる因果関係は否定できないものと推察され、発症直前(4日前及び25日前)に投与されたワクチンが、致死的な血小板減少を誘発し、その結果、くも膜下出血をきたした原因薬剤として、現時点で最も可能性が高いと考える。
注12:当院受診歴(合計3回)
注13:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注14:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
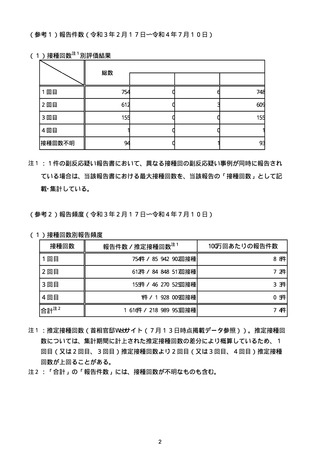
注15:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。
注16:2か所の搬送先医療機関から同一症例について報告あり。本表の記載内容は、両報告内容に基づく。
256