よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
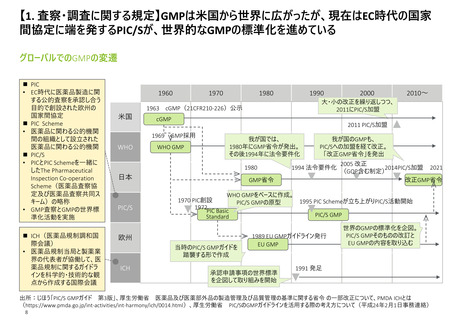
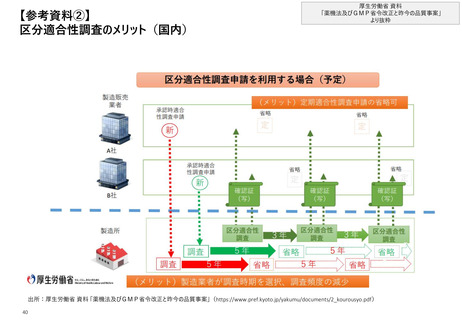
【1. 査察・調査に関する規定】
GMPの標準化が進む一方で、各国間での協定の締結による相互承認も行われている
MRA等による相互承認
相互承認協定(Mutual Recognition Agreements)とは、相互承認の参加機関が、他の参加機関の適合性評価結果を、自ら実施したものと同等
であるとして相互に承認するために締結する協定である。各国は、MRAおよびそれに類する締結によって、相互承認の枠組みを整備している
(EU脱退後)
日本
• 2001年に日・欧州共同体相
互承認協定に署名・2002年
に発効した
• 協定で定められている4つの
分野のうち、1つが医薬品に
関するGMPである
日英包括的
経済連携協定*
MRA締結
※日米間のMRAは2022年11月時点
で締結されていない
• 2018年7月の署名交換により、相互承認の対
象医薬品は原薬、無菌医薬品、ワクチン等の
生物学的医薬品にも拡大された。
• 日本とEU加盟各国の規制当局は、相手側当
局によるGMP適合性確認結果を相互に受け
入れることとなった。
• また、該当する輸入製品を扱う国内製造業者
は、輸出元の外国製造業者が行った試験検
査の記録を確認することで、輸入製品の試験
検査に代えることができることとなった。
• これらにより、”流通する製品の一層効率的な
品質確保につながること”が期待されている
英国
(EU脱退後”も”)
MRA締結
(EU脱退後)
EU-UK Trade and
Cooperation Agreement
欧州
• 日本・米国・他5か国と、GMP査察に
関する相互承認を含む相互承認協
定を締結した
• EU域内における加盟国の相互承認の
仕組みも有する
• 英国のEU離脱後、英国とは別途協
定を締結している
MRA締結
他5か国
MRA締結
米国
• EU及び英国とそれぞれ相互
承認協定を締結した
• 英国がEUから離脱した2021
年1月1日以降も英国との協
働を継続している
• EU-米国間の相互承認協定は2017年に発効
し、移行期間を経て2019年にヒト用医薬品に
関して完全に運用可能となった。
• 相互承認協定は、それぞれの査察官が、お互
いの域内で行われた医薬品査察から得られた
情報を利用することを認めている
オーストラリア/カナダ/イスラエル/
ニュージーランド/スイス
出所:経済産業省 (https://www.meti.go.jp/policy/economy/hyojun-kijun/mr/mr.html)、(https://www.meti.go.jp/policy/trade_policy/epa/epa/en/index.html)、
外務省(https://www.mofa.go.jp/mofaj/area/eu/s_kyotei/pdfs/shonin.pdf)、(https://www.mofa.go.jp/mofaj/ecm/ie/page24_001186.html)、厚生労働省 報道資料
(https://www.mhlw.go.jp/stf/newpage_00364.html)、FDA Mutual Recognition Agreement (MRA)、EMA Mutual recognition agreements(MRA)、EMA Authorisation of
11 medicines、 EMA International collaboration on GMP
*:協定の一部を成す「相互承認に関する議定書」の中で、「医薬品に係る優良製造所基準(GMP)に関する分野別附属書」が規定されている
GMPの標準化が進む一方で、各国間での協定の締結による相互承認も行われている
MRA等による相互承認
相互承認協定(Mutual Recognition Agreements)とは、相互承認の参加機関が、他の参加機関の適合性評価結果を、自ら実施したものと同等
であるとして相互に承認するために締結する協定である。各国は、MRAおよびそれに類する締結によって、相互承認の枠組みを整備している
(EU脱退後)
日本
• 2001年に日・欧州共同体相
互承認協定に署名・2002年
に発効した
• 協定で定められている4つの
分野のうち、1つが医薬品に
関するGMPである
日英包括的
経済連携協定*
MRA締結
※日米間のMRAは2022年11月時点
で締結されていない
• 2018年7月の署名交換により、相互承認の対
象医薬品は原薬、無菌医薬品、ワクチン等の
生物学的医薬品にも拡大された。
• 日本とEU加盟各国の規制当局は、相手側当
局によるGMP適合性確認結果を相互に受け
入れることとなった。
• また、該当する輸入製品を扱う国内製造業者
は、輸出元の外国製造業者が行った試験検
査の記録を確認することで、輸入製品の試験
検査に代えることができることとなった。
• これらにより、”流通する製品の一層効率的な
品質確保につながること”が期待されている
英国
(EU脱退後”も”)
MRA締結
(EU脱退後)
EU-UK Trade and
Cooperation Agreement
欧州
• 日本・米国・他5か国と、GMP査察に
関する相互承認を含む相互承認協
定を締結した
• EU域内における加盟国の相互承認の
仕組みも有する
• 英国のEU離脱後、英国とは別途協
定を締結している
MRA締結
他5か国
MRA締結
米国
• EU及び英国とそれぞれ相互
承認協定を締結した
• 英国がEUから離脱した2021
年1月1日以降も英国との協
働を継続している
• EU-米国間の相互承認協定は2017年に発効
し、移行期間を経て2019年にヒト用医薬品に
関して完全に運用可能となった。
• 相互承認協定は、それぞれの査察官が、お互
いの域内で行われた医薬品査察から得られた
情報を利用することを認めている
オーストラリア/カナダ/イスラエル/
ニュージーランド/スイス
出所:経済産業省 (https://www.meti.go.jp/policy/economy/hyojun-kijun/mr/mr.html)、(https://www.meti.go.jp/policy/trade_policy/epa/epa/en/index.html)、
外務省(https://www.mofa.go.jp/mofaj/area/eu/s_kyotei/pdfs/shonin.pdf)、(https://www.mofa.go.jp/mofaj/ecm/ie/page24_001186.html)、厚生労働省 報道資料
(https://www.mhlw.go.jp/stf/newpage_00364.html)、FDA Mutual Recognition Agreement (MRA)、EMA Mutual recognition agreements(MRA)、EMA Authorisation of
11 medicines、 EMA International collaboration on GMP
*:協定の一部を成す「相互承認に関する議定書」の中で、「医薬品に係る優良製造所基準(GMP)に関する分野別附属書」が規定されている