よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
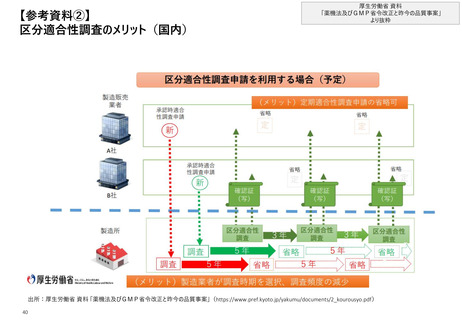
【1. 査察・調査に関する規定】GMP調査や査察を行うタイミングや目的といった、”位置づ
け”に関しても、法令や規制当局のHP上で言及されている
日米欧におけるGMP査察・調査*1の位置づけ
日本
米国
欧州
◼ 薬機法
◼ FDA HP-FDA What does FDA
◼ Directive 2001/83/EC(指令)
inspect?
⇒ 第14条第7項 その物の製造所における製造管理又は品質
⇒ Article 111 Paragraph 1
管理の方法が厚生労働省令で定める基準に適合している ⇒ FDAは、FDAが規定する製品の製造
加盟国の規制当局は定期的な査察
かどうかについて、当該承認(=品目ごとの製造販売承
業者や加工業者が、関連規定に準
や、必要な場合は無通告の査察に
認)を受けようとするとき、及び当該承認の取得後三年を
拠していることを確認するため査察を
よって、法的な要件が遵守されている
下らない政令で定める期間*2を経過するごとに厚生労働大
行う。
ことを保証する。
臣の書面による調査または実地の調査を受けなければなら
査察対象には医薬品の製造業者が
所管官庁はGMP不遵守を疑う根拠
ない
含まれる
がある時には、出発原料の製造所や
販売許可保有者の施設の無通告
※FDA HP上で査察についてまとめられ
⇒ 第69条 厚生労働大臣または都道府県知事は、製造販売
査察も行うことができる。
ているページより抜粋
業者等が、第14条第2項(略)の規定を遵守しているか
これらの査察は加盟国や委員会
確かめるために必要があると認めるときは、立入検査を行う
(the Commission)・機関(the
ことができる
GMP査察・調査の <GMP基準適合を証する基準確認証の交付を受ける場合>
Agency)の要請、または製造業者
自身の特定の要請(specific
位置づけに関する ⇒ 第14条の2
request)により行うこともできる
言及概要
第2項 厚生労働大臣は、前項の確認(=製造工程の区
⇒ Article 111 Paragraph 5
分ごとの確認、すなわち区分適合性調査)を求められたと
きは、書面による調査又は実地の調査を行うものとする
GMPが遵守されている場合には製造
第3項 厚生労働大臣は、厚生労働省で定める基準に適合
業者に対して証明書が発行される
していると認められたときは、製造工程の区分ごとに、基準
確認証を交付する
第4項 前項の基準確認証の有効期間は、当該基準確認
証の交付の日から起算して政令で定める期間*3とする
⇒ 第14条第8項 第1項の承認(=品目ごとの製造販売承
認)を受けた者は、その承認等に係る医薬品等が基準確
認証の交付を受けているときは、当該製造工程に係る前項
(第14条第7項)の調査を受けることを要しない
出所:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令、FDA HP
(https://www.fda.gov/about-fda/fda-basics/what-does-fda-inspect)、Directive 2001/83/EC
*1:日本においては「実地の調査」「立入検査」、欧米においては「査察(inspection)」の文言が使用されている。以降のページでは、これらをまとめて「査察・調査」と称する
2
6 * :政令で定める期間は、薬機法施行令第21条において5年とされている
*3:政令で定める期間は、薬機法施行令第26条の3において3年とされている
け”に関しても、法令や規制当局のHP上で言及されている
日米欧におけるGMP査察・調査*1の位置づけ
日本
米国
欧州
◼ 薬機法
◼ FDA HP-FDA What does FDA
◼ Directive 2001/83/EC(指令)
inspect?
⇒ 第14条第7項 その物の製造所における製造管理又は品質
⇒ Article 111 Paragraph 1
管理の方法が厚生労働省令で定める基準に適合している ⇒ FDAは、FDAが規定する製品の製造
加盟国の規制当局は定期的な査察
かどうかについて、当該承認(=品目ごとの製造販売承
業者や加工業者が、関連規定に準
や、必要な場合は無通告の査察に
認)を受けようとするとき、及び当該承認の取得後三年を
拠していることを確認するため査察を
よって、法的な要件が遵守されている
下らない政令で定める期間*2を経過するごとに厚生労働大
行う。
ことを保証する。
臣の書面による調査または実地の調査を受けなければなら
査察対象には医薬品の製造業者が
所管官庁はGMP不遵守を疑う根拠
ない
含まれる
がある時には、出発原料の製造所や
販売許可保有者の施設の無通告
※FDA HP上で査察についてまとめられ
⇒ 第69条 厚生労働大臣または都道府県知事は、製造販売
査察も行うことができる。
ているページより抜粋
業者等が、第14条第2項(略)の規定を遵守しているか
これらの査察は加盟国や委員会
確かめるために必要があると認めるときは、立入検査を行う
(the Commission)・機関(the
ことができる
GMP査察・調査の <GMP基準適合を証する基準確認証の交付を受ける場合>
Agency)の要請、または製造業者
自身の特定の要請(specific
位置づけに関する ⇒ 第14条の2
request)により行うこともできる
言及概要
第2項 厚生労働大臣は、前項の確認(=製造工程の区
⇒ Article 111 Paragraph 5
分ごとの確認、すなわち区分適合性調査)を求められたと
きは、書面による調査又は実地の調査を行うものとする
GMPが遵守されている場合には製造
第3項 厚生労働大臣は、厚生労働省で定める基準に適合
業者に対して証明書が発行される
していると認められたときは、製造工程の区分ごとに、基準
確認証を交付する
第4項 前項の基準確認証の有効期間は、当該基準確認
証の交付の日から起算して政令で定める期間*3とする
⇒ 第14条第8項 第1項の承認(=品目ごとの製造販売承
認)を受けた者は、その承認等に係る医薬品等が基準確
認証の交付を受けているときは、当該製造工程に係る前項
(第14条第7項)の調査を受けることを要しない
出所:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行令、FDA HP
(https://www.fda.gov/about-fda/fda-basics/what-does-fda-inspect)、Directive 2001/83/EC
*1:日本においては「実地の調査」「立入検査」、欧米においては「査察(inspection)」の文言が使用されている。以降のページでは、これらをまとめて「査察・調査」と称する
2
6 * :政令で定める期間は、薬機法施行令第21条において5年とされている
*3:政令で定める期間は、薬機法施行令第26条の3において3年とされている