よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
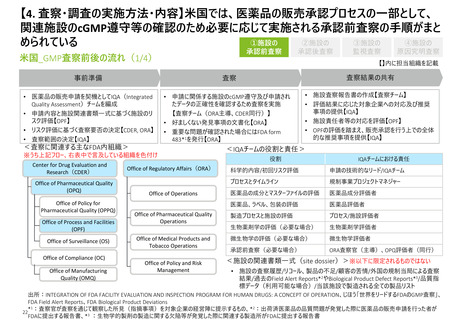
【4. 査察・調査の実施方法・内容】米国では、医薬品や原薬を製造している施設のcGMP
遵守を監視するために行われる監視査察の手順がまとめられている
①施設の
承認前査察
米国_GMP査察前後の流れ(3/4)
事前準備
• リスクベースの施設選択モデル
(risk-based site selection
model)によるリスク評価
【OS】
• 査察の計画策定【ORA】
• 更新された施設の関連書式
一式を準備【OS】
<査察に関連する主なFDA内組織>※うち上記言及組織を色付け
Office of Policy for
Pharmaceutical Quality (OPPQ)
Office of Process and Facilities
(OPF)
Office of Surveillance (OS)
Office of Compliance (OC)
Office of Manufacturing
Quality (OMQ)
査察結果の共有
• Surveillance Compliance Program*1と施設の関連書類一
式を元に査察を実施
【査察チーム( ORA主導、CDERも同行の場合有)】
• 重大な不備が発見された場合には査察の継続・終了の判
断のため協議を実施【ORA、OMQ】
• 好ましくない発見事項があった場合にはFDA form 483を発
行し、査察終了時に対象企業と協議を実施【査察チーム】
Office of Pharmaceutical Quality
(OPQ)
③施設の
監視査察
④施設の
原因究明査察
【】内に担当組織を記載
査察
Center for Drug Evaluation and
Research(CDER)
②施設の
承認後査察
Office of Regulatory Affairs(ORA)
Office of Operations
Office of Pharmaceutical Quality
Operations
Office of Medical Products and
Tobacco Operations
• (可能な限り速やかに)
公式措置の可能性がある
場合はPanorama*2に情
報を入力【ORA】
• (45日以内)施設査察
報告書の作成【ORA】
監視分析
• 傾向把握のための分析の
実施【OS】
• 好ましくない品質傾向への
対応【OS、ORA】
• 施設の関連書類一式の
更新【OS】*3
<”査察結果の共有”を行う際の分類>
分類(classifications)
定義
Official Action
Indicated (OAI)
公式措置指示あり
(好ましくない所見が発見され、規制措置が
推奨される場合、当該分類とされる)
Voluntary Action
Indicated (VAI)
自発的措置指示あり
(好ましくない所見が発見されたが、是正措
置は対象施設の自主性に任される場合、当
該分類とされる)
よ
り
重
い
No Action
Indicated (NAI)
対応措置指示なし
Office of Policy and Risk
Management
出所:INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 FDA Drug Compliance Programs DRUG
MANUFACTURING INSPECTION、じほう「世界をリードするFDAのGMP査察」、FMD 86: Establishment Inspection Report Conclusions and Decisions
*1: FDA Drug Compliance Programs DRUG MANUFACTURING INSPECTIONでまとめられている詳細手順、*2:CDERのタイムレポートとワークフローの管理を行うシステム
3
24 * :A CONCEPT OF OPERATIONの本文中には記載がないが、同資料中のフロー図より説明に追加。明記はされていないが、監視査察や原因究明査察の結果を踏まえ更新された
施設の関連書類一式が、同施設で製造される別の医薬品承認前のリスク評価時や、次の監視査察の際に参照されるものと思料
遵守を監視するために行われる監視査察の手順がまとめられている
①施設の
承認前査察
米国_GMP査察前後の流れ(3/4)
事前準備
• リスクベースの施設選択モデル
(risk-based site selection
model)によるリスク評価
【OS】
• 査察の計画策定【ORA】
• 更新された施設の関連書式
一式を準備【OS】
<査察に関連する主なFDA内組織>※うち上記言及組織を色付け
Office of Policy for
Pharmaceutical Quality (OPPQ)
Office of Process and Facilities
(OPF)
Office of Surveillance (OS)
Office of Compliance (OC)
Office of Manufacturing
Quality (OMQ)
査察結果の共有
• Surveillance Compliance Program*1と施設の関連書類一
式を元に査察を実施
【査察チーム( ORA主導、CDERも同行の場合有)】
• 重大な不備が発見された場合には査察の継続・終了の判
断のため協議を実施【ORA、OMQ】
• 好ましくない発見事項があった場合にはFDA form 483を発
行し、査察終了時に対象企業と協議を実施【査察チーム】
Office of Pharmaceutical Quality
(OPQ)
③施設の
監視査察
④施設の
原因究明査察
【】内に担当組織を記載
査察
Center for Drug Evaluation and
Research(CDER)
②施設の
承認後査察
Office of Regulatory Affairs(ORA)
Office of Operations
Office of Pharmaceutical Quality
Operations
Office of Medical Products and
Tobacco Operations
• (可能な限り速やかに)
公式措置の可能性がある
場合はPanorama*2に情
報を入力【ORA】
• (45日以内)施設査察
報告書の作成【ORA】
監視分析
• 傾向把握のための分析の
実施【OS】
• 好ましくない品質傾向への
対応【OS、ORA】
• 施設の関連書類一式の
更新【OS】*3
<”査察結果の共有”を行う際の分類>
分類(classifications)
定義
Official Action
Indicated (OAI)
公式措置指示あり
(好ましくない所見が発見され、規制措置が
推奨される場合、当該分類とされる)
Voluntary Action
Indicated (VAI)
自発的措置指示あり
(好ましくない所見が発見されたが、是正措
置は対象施設の自主性に任される場合、当
該分類とされる)
よ
り
重
い
No Action
Indicated (NAI)
対応措置指示なし
Office of Policy and Risk
Management
出所:INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 FDA Drug Compliance Programs DRUG
MANUFACTURING INSPECTION、じほう「世界をリードするFDAのGMP査察」、FMD 86: Establishment Inspection Report Conclusions and Decisions
*1: FDA Drug Compliance Programs DRUG MANUFACTURING INSPECTIONでまとめられている詳細手順、*2:CDERのタイムレポートとワークフローの管理を行うシステム
3
24 * :A CONCEPT OF OPERATIONの本文中には記載がないが、同資料中のフロー図より説明に追加。明記はされていないが、監視査察や原因究明査察の結果を踏まえ更新された
施設の関連書類一式が、同施設で製造される別の医薬品承認前のリスク評価時や、次の監視査察の際に参照されるものと思料