よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
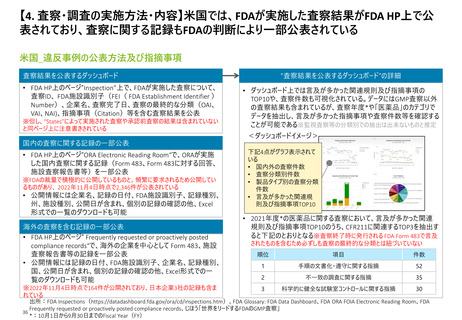
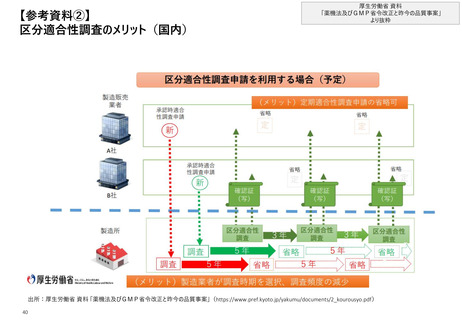
【4. 査察・調査の実施方法・内容】欧州では、製造業者等に対する通常のGMP査察*1及
び特定の製品に関する査察*2を包含した査察手順がまとめられている
欧州_GMP査察前後の流れ
①通常のGMP
査察
※各加盟国がそれぞれGMPについての手順を作成するための基本として提供されている
事前準備
• 査察が適切な方法で実施されるために必要なリ
ソースの確保
• 医薬品製造業者に対する査察のためのリスクベー
ス計画モデル(A model for risk based planning
for inspections of pharmaceutical
manufacturers)に基づく査察計画の策定
• 対象企業についての事前インプット
査察
•
•
•
•
•
事前通告*3
オープニングミーティング
査察の実施
文書の確認
ファイナルミーティング
②特定の製品/
製造工程に
関連する査察
査察報告書の送付及び最終化
• 査察報告書を対象企業に対して送付しコメントを
依頼
• 所定の期間内に報告書の最終化
• 該当する場合には法定90日間の期間内にGMP
証明書を発行
<”査察報告書” に記載される不備の分類>
<GMP証明書>※Union Formatの一部を以下に抜粋
• 査察報告書はUnion Formatに従って作成すると定められており、Union Formatの
中では査察中に確認された全ての不備をリストアップすることが求められている
• 不備分類は以下のとおり定義されている
• GMP遵守を確認したことの証明として、Union Formatに従って発行される
• 加盟国はGMP証明書をEMAが管理するデータベース(EudraGMDP)に入力する
必要がある
• GMP不遵守と判断された場合にも、当該情報がデータベースに入力される
不備(Deficiency)分類
定義
Critical Deficiency
患者にとって有害な製品を製造した又は製造する
重大なリスクにつながる不備
よ
り
Major Deficiency
重
い
販売許可を遵守していない医薬品を製造した又
は製造する可能性のある不備、GMPから大きく逸
脱していることを示す不備、バッチリリースの手順を
十分に遵守していなかった又は有資格者が法的
義務を履行しなかったことを示す不備、複数
の”Other”が合わさった結果“Major”相当となる可
能性がある不備
Other Deficiency
Critical又はMajorに分類できないがGMPから乖離
が見られる不備
GMP遵守を確認した加盟国、
対象となる製造業者の名称、
住所、査察実施日時等の
情報が記載される
出所:EMA Compilation of Union Procedures on Inspections and Exchange of Information、 Directive 2001/83/EC
*1:製造許可前に実施されるGMP査察及び許可後に定期的に行われる査察であり、前回の査察で必要とされた是正活動の監視を行うためのフォローアップ査察も包含
*2:特定の製品に関する製造業者の遵守状況に焦点をあてた査察。製品のリコールや通報により1製品、複数の製品、加工手順等等の査察を行う場合もある
26 3
* :規制当局はいつでも査察を行える権利を有しているが、事前通告を行う場合もあると規定されている
び特定の製品に関する査察*2を包含した査察手順がまとめられている
欧州_GMP査察前後の流れ
①通常のGMP
査察
※各加盟国がそれぞれGMPについての手順を作成するための基本として提供されている
事前準備
• 査察が適切な方法で実施されるために必要なリ
ソースの確保
• 医薬品製造業者に対する査察のためのリスクベー
ス計画モデル(A model for risk based planning
for inspections of pharmaceutical
manufacturers)に基づく査察計画の策定
• 対象企業についての事前インプット
査察
•
•
•
•
•
事前通告*3
オープニングミーティング
査察の実施
文書の確認
ファイナルミーティング
②特定の製品/
製造工程に
関連する査察
査察報告書の送付及び最終化
• 査察報告書を対象企業に対して送付しコメントを
依頼
• 所定の期間内に報告書の最終化
• 該当する場合には法定90日間の期間内にGMP
証明書を発行
<”査察報告書” に記載される不備の分類>
<GMP証明書>※Union Formatの一部を以下に抜粋
• 査察報告書はUnion Formatに従って作成すると定められており、Union Formatの
中では査察中に確認された全ての不備をリストアップすることが求められている
• 不備分類は以下のとおり定義されている
• GMP遵守を確認したことの証明として、Union Formatに従って発行される
• 加盟国はGMP証明書をEMAが管理するデータベース(EudraGMDP)に入力する
必要がある
• GMP不遵守と判断された場合にも、当該情報がデータベースに入力される
不備(Deficiency)分類
定義
Critical Deficiency
患者にとって有害な製品を製造した又は製造する
重大なリスクにつながる不備
よ
り
Major Deficiency
重
い
販売許可を遵守していない医薬品を製造した又
は製造する可能性のある不備、GMPから大きく逸
脱していることを示す不備、バッチリリースの手順を
十分に遵守していなかった又は有資格者が法的
義務を履行しなかったことを示す不備、複数
の”Other”が合わさった結果“Major”相当となる可
能性がある不備
Other Deficiency
Critical又はMajorに分類できないがGMPから乖離
が見られる不備
GMP遵守を確認した加盟国、
対象となる製造業者の名称、
住所、査察実施日時等の
情報が記載される
出所:EMA Compilation of Union Procedures on Inspections and Exchange of Information、 Directive 2001/83/EC
*1:製造許可前に実施されるGMP査察及び許可後に定期的に行われる査察であり、前回の査察で必要とされた是正活動の監視を行うためのフォローアップ査察も包含
*2:特定の製品に関する製造業者の遵守状況に焦点をあてた査察。製品のリコールや通報により1製品、複数の製品、加工手順等等の査察を行う場合もある
26 3
* :規制当局はいつでも査察を行える権利を有しているが、事前通告を行う場合もあると規定されている