よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
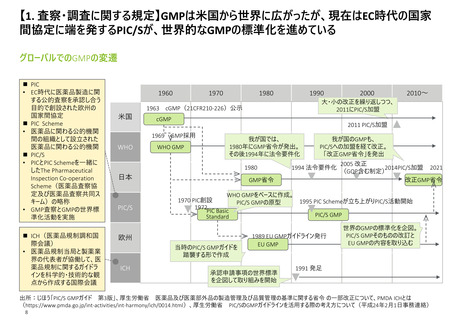
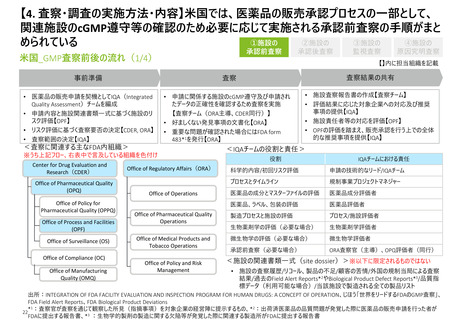
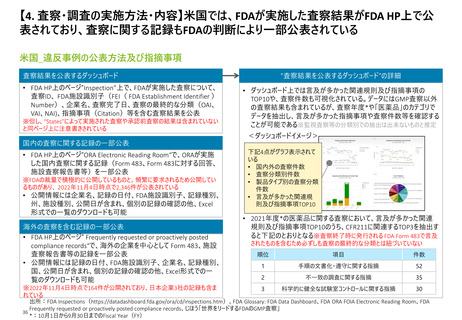
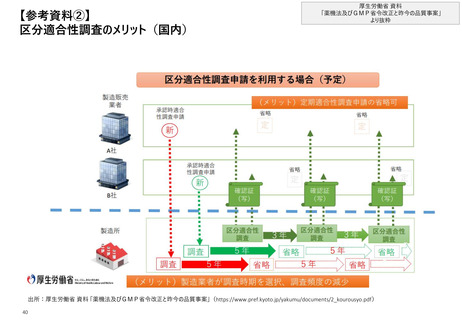
【4.査察・調査の実施方法・内容】
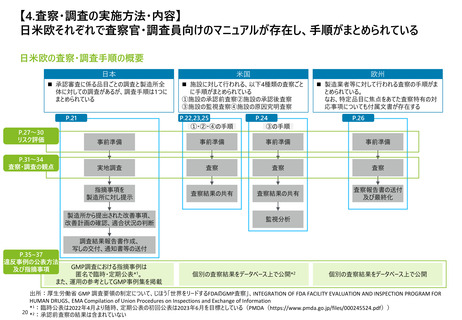
日米欧それぞれで査察官・調査員向けのマニュアルが存在し、手順がまとめられている
日米欧の査察・調査手順の概要
日本
米国
欧州
◼ 承認審査に係る品目ごとの調査と製造所全
体に対しての調査があるが、調査手順は1つに
まとめられている
◼ 施設に対して行われる、以下4種類の査察ごと
に手順がまとめられている
①施設の承認前査察②施設の承認後査察
③施設の監視査察④施設の原因究明査察
◼ 製造業者等に対して行われる査察の手順がま
とめられている。
なお、特定品目に焦点をあてた査察特有の対
応事項についても付属文書が存在する
P.21
P.22,23,25
①・②・④の手順
P.24
③の手順
P.26
P.27~30
リスク評価
事前準備
事前準備
事前準備
事前準備
P.31~34
査察・調査の観点
実地調査
査察
査察
査察
指摘事項を
製造所に対し提示
査察結果の共有
査察結果の共有
査察報告書の送付
及び最終化
製造所から提出された改善事項、
改善計画の確認、適合状況の判断
監視分析
調査結果報告書作成、
写しの交付、通知書等の送付
P.35~37
違反事例の公表方法
及び指摘事項
GMP調査における指摘事例は
匿名で臨時・定期公表*1。
また、運用の参考としてGMP事例集を掲載
個別の査察結果をデータベース上で公開*2
個別の査察結果をデータベース上で公開
出所:厚生労働省 GMP 調査要領の制定について、じほう「世界をリードするFDAのGMP査察」、INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR
HUMAN DRUGS、EMA Compilation of Union Procedures on Inspections and Exchange of Information
*1:臨時公表は2022年4月より随時、定期公表の初回公表は2023年6月を目標としている(PMDA(https://www.pmda.go.jp/files/000245524.pdf))
20 2
* :承認前査察の結果は含まれていない
日米欧それぞれで査察官・調査員向けのマニュアルが存在し、手順がまとめられている
日米欧の査察・調査手順の概要
日本
米国
欧州
◼ 承認審査に係る品目ごとの調査と製造所全
体に対しての調査があるが、調査手順は1つに
まとめられている
◼ 施設に対して行われる、以下4種類の査察ごと
に手順がまとめられている
①施設の承認前査察②施設の承認後査察
③施設の監視査察④施設の原因究明査察
◼ 製造業者等に対して行われる査察の手順がま
とめられている。
なお、特定品目に焦点をあてた査察特有の対
応事項についても付属文書が存在する
P.21
P.22,23,25
①・②・④の手順
P.24
③の手順
P.26
P.27~30
リスク評価
事前準備
事前準備
事前準備
事前準備
P.31~34
査察・調査の観点
実地調査
査察
査察
査察
指摘事項を
製造所に対し提示
査察結果の共有
査察結果の共有
査察報告書の送付
及び最終化
製造所から提出された改善事項、
改善計画の確認、適合状況の判断
監視分析
調査結果報告書作成、
写しの交付、通知書等の送付
P.35~37
違反事例の公表方法
及び指摘事項
GMP調査における指摘事例は
匿名で臨時・定期公表*1。
また、運用の参考としてGMP事例集を掲載
個別の査察結果をデータベース上で公開*2
個別の査察結果をデータベース上で公開
出所:厚生労働省 GMP 調査要領の制定について、じほう「世界をリードするFDAのGMP査察」、INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR
HUMAN DRUGS、EMA Compilation of Union Procedures on Inspections and Exchange of Information
*1:臨時公表は2022年4月より随時、定期公表の初回公表は2023年6月を目標としている(PMDA(https://www.pmda.go.jp/files/000245524.pdf))
20 2
* :承認前査察の結果は含まれていない