よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
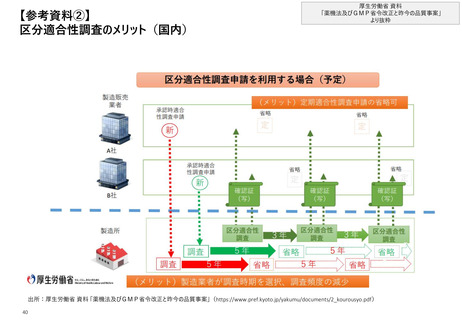
【4. 査察・調査の実施方法・内容】日本では、リスク評価に基づいて1~3年毎にGMP調査
を実施しており、3年間実地の調査を行っていない場合には原則実地の調査を行う
日本_リスク評価
◼ 調査当局は、GMP調査*の内容、頻度、手法及び期間の決定にあたって下記の考慮すべき事項を勘案したリスク評価に基づいて1~3年毎に調査
を行う。リスク評価により書面調査も活用するが、適合性調査・確認申請を受けた日から少なくとも過去3年間の間に実地のGMP調査を実施して
いない場合においては、原則として実地調査を行う。また、リスクの高い製造所については、原則、年1回以上の無通告調査を行う
◼ 考慮すべき事項及び事前資料を踏まえ、調査の基本方針が決定される
※書面調査の場合の詳細な手順及び一度行ったリスク評価がその後どのように活用・更新されるのかの詳細については現時点で情報を収集できていない
<調査の内容、頻度、手法及び期間の決定に当たって考慮すべき事項>
考慮すべき事項
品目(製品)
種類
工程内容
その他製造所の
状況
剤形、生物由来医薬品等か否か、無菌医薬品か否か、用量の少ないもの、治療域の狭いもの、特殊な製剤技術によるもの等
滅菌・無菌操作の有無、作業環境管理内容、製造工程の複雑さ等
職員数、不正が発覚した場合の影響範囲の大きさ等
変更履歴
適合性調査を受ける必要がある製造販売承認事項一部変更のほか、交叉汚染、混同等のリスクに影響を及ぼし得る次のような変更
・製造所所有者(製造業者等)の変更
・製造所の変更(場所等)
・品質に影響を及ぼし得る構造設備の変更
・品質に影響を及ぼし得る責任者等の変更
・新たなカテゴリーの品目(製品)の追加
・新たな教育訓練を要する新しい設備器具の導入
製造所履歴
初回調査か否か、前回調査結果、前回調査以後の回収や品質情報等の有無及び内容、基準確認証の有無、他の調査権者等の調
査結果や不適合の有無、前回調査から経過した期間、外国等当局からの情報等
品目(製品)
履歴
27
具体例
副作用報告又は不具合報告その他市販後に得られた情報、一斉監視指導結果、外国等当局からの情報等
出所:厚生労働省 GMP 調査要領の制定について
*:GMP調査要領においては、適合性調査及び立入検査等の総称として「GMP調査」の名称が使用されている
を実施しており、3年間実地の調査を行っていない場合には原則実地の調査を行う
日本_リスク評価
◼ 調査当局は、GMP調査*の内容、頻度、手法及び期間の決定にあたって下記の考慮すべき事項を勘案したリスク評価に基づいて1~3年毎に調査
を行う。リスク評価により書面調査も活用するが、適合性調査・確認申請を受けた日から少なくとも過去3年間の間に実地のGMP調査を実施して
いない場合においては、原則として実地調査を行う。また、リスクの高い製造所については、原則、年1回以上の無通告調査を行う
◼ 考慮すべき事項及び事前資料を踏まえ、調査の基本方針が決定される
※書面調査の場合の詳細な手順及び一度行ったリスク評価がその後どのように活用・更新されるのかの詳細については現時点で情報を収集できていない
<調査の内容、頻度、手法及び期間の決定に当たって考慮すべき事項>
考慮すべき事項
品目(製品)
種類
工程内容
その他製造所の
状況
剤形、生物由来医薬品等か否か、無菌医薬品か否か、用量の少ないもの、治療域の狭いもの、特殊な製剤技術によるもの等
滅菌・無菌操作の有無、作業環境管理内容、製造工程の複雑さ等
職員数、不正が発覚した場合の影響範囲の大きさ等
変更履歴
適合性調査を受ける必要がある製造販売承認事項一部変更のほか、交叉汚染、混同等のリスクに影響を及ぼし得る次のような変更
・製造所所有者(製造業者等)の変更
・製造所の変更(場所等)
・品質に影響を及ぼし得る構造設備の変更
・品質に影響を及ぼし得る責任者等の変更
・新たなカテゴリーの品目(製品)の追加
・新たな教育訓練を要する新しい設備器具の導入
製造所履歴
初回調査か否か、前回調査結果、前回調査以後の回収や品質情報等の有無及び内容、基準確認証の有無、他の調査権者等の調
査結果や不適合の有無、前回調査から経過した期間、外国等当局からの情報等
品目(製品)
履歴
27
具体例
副作用報告又は不具合報告その他市販後に得られた情報、一斉監視指導結果、外国等当局からの情報等
出所:厚生労働省 GMP 調査要領の制定について
*:GMP調査要領においては、適合性調査及び立入検査等の総称として「GMP調査」の名称が使用されている