よむ、つかう、まなぶ。
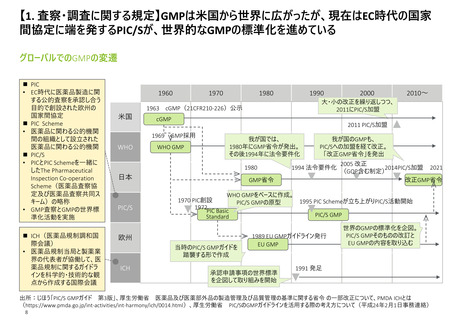
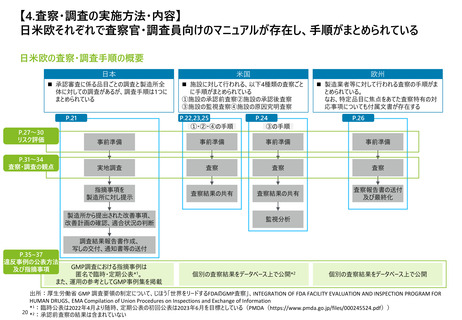
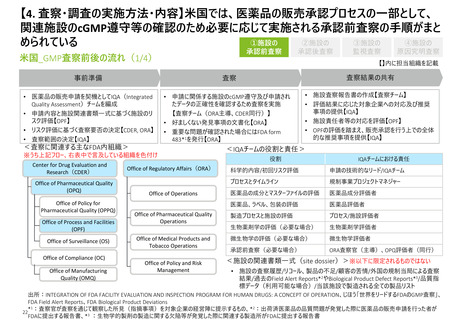
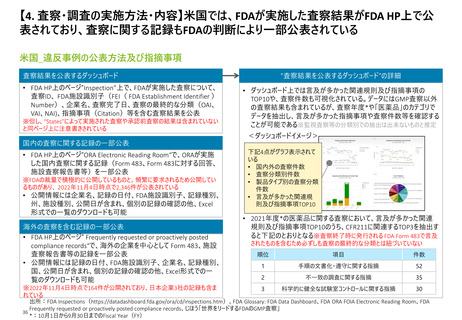
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
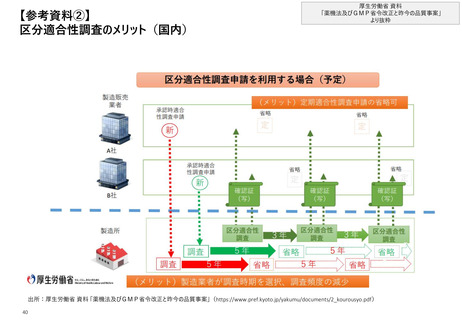
【4. 査察・調査の実施方法・内容】日本では、調査の観点が6つの調査対象サブシステムと
してまとめられており、対象となるサブシステムは調査により異なる
①適合性調査・
確認
日本_調査の観点
②立入検査等
◼ GMP調査*においては、調査計画策定時に調査対象サブシステム(構成要素)を明らかにする
◼ 製造所全体についてのGMP調査においては、下記の製造管理及び品質管理の主たるサブシステムを踏まえて行うことにより、GMP省令の個々の要
求事項への適合性に加えて、製造所の管理が効果的に機能しているかを総合的かつ効率的に評価する。製造所全体の調査においては少なくとも
4つのサブシステムを調査する
◼ 品質サブシステムについては、必ずその他1以上のサブシステムを調査の対象とする
※明記はされていないが、特定の品目の調査の際にも、品質サブシステムを調査するにあたってはその他1以上のサブシステムも併せて調査する必要があるとの内容であると推定
サブシステム
調査項目
品質
①組織②医薬品製品標準書、医薬部外品製品標準書③文書管理(データインテグリティ(以下「DI」)を含む)④出荷管理⑤変更管理⑥
逸脱管理⑦品質情報・品質不良(苦情)⑧自己点検⑨回収処理⑩GMP教育訓練⑪製造販売業者との合意事項(承認事項を含む。)
の遵守⑫品質方針・品質目標⑬品質マニュアル⑭製品品質の照査⑮是正措置・予防措置⑯原材料等の供給者管理⑰製造業者等(責任
役員)の責任⑱マネジメントレビュー・内部の情報伝達・資源の配分⑲技術移転⑳品質リスクマネジメント㉑外部委託業者管理
構造設備
①手順書・記録書(DIを含む)②図面管理③建屋・施設(作業室含む)及び設備と適格性確認(製造用水・製造設備・空調設備)建物
及び施設④設備・機器管理(メンテナンス)⑤コンピュータ管理⑥校正⑦製造用水管理⑧空調管理⑨遮光管理⑩出入り口管理⑪構造躯体
管理⑫衛生管理⑬防虫・防そ管理⑭交叉汚染の防止⑮封じ込め措置
製品原料
資材保管等
①手順書・記録書(DIを含む)②受け入れ管理③区分保管管理④表示管理⑤出納管理⑥不合格品管理⑦施設及び設備の適格性確認
⑧設備・機器管理⑨校正⑩衛生管理⑪環境管理⑫防虫・防そ管理⑬出荷作業⑭教育訓練
製造
(一般)
①手順書類②製造指図書・記録書管理(DIを含む)③作業前確認④工程管理⑤異物混入・汚染・混同防止⑥設備・機器管理⑦校正⑧
動線⑨ゾーニング(区分)⑩防虫・防そ管理⑪作業着管理⑫衛生管理⑬環境管理⑭微生物学的モニタリング⑮バリデーション⑯教育訓練
包装表示
①手順書・記録書(DIを含む)②作業前確認③表示材料管理④工程管理⑤汚染・混同防止⑥施設及び設備の適格性確認⑦設備・機器
管理⑧校正⑨衛生管理⑩作業着管理⑪動線⑫ゾーニング(区分)⑬防虫・防そ管理⑭環境管理⑮バリデーション⑯教育訓練
試験検査
①手順書・記録書(DIを含む)②検体採取③施設及び設備の管理④設備・機器管理⑤校正⑥試薬・試液・標準品管理⑦試験用水管理
⑧試験動物管理⑨試験検査結果判定・逸脱管理⑩合格ラベル・情報管理⑪参考品・保存品管理⑫衛生管理⑬安定性モニタリング⑭バリ
デーション(分析法バリデーション)⑮委託試験管理⑯教育訓練⑰試験室環境管理⑱微生物試験管理⑲無菌試験管理
出所:厚生労働省 GMP調査要領の制定について
*:GMP調査要領においては、適合性調査及び立入検査等の総称として「GMP調査」の名称が使用されている
31
してまとめられており、対象となるサブシステムは調査により異なる
①適合性調査・
確認
日本_調査の観点
②立入検査等
◼ GMP調査*においては、調査計画策定時に調査対象サブシステム(構成要素)を明らかにする
◼ 製造所全体についてのGMP調査においては、下記の製造管理及び品質管理の主たるサブシステムを踏まえて行うことにより、GMP省令の個々の要
求事項への適合性に加えて、製造所の管理が効果的に機能しているかを総合的かつ効率的に評価する。製造所全体の調査においては少なくとも
4つのサブシステムを調査する
◼ 品質サブシステムについては、必ずその他1以上のサブシステムを調査の対象とする
※明記はされていないが、特定の品目の調査の際にも、品質サブシステムを調査するにあたってはその他1以上のサブシステムも併せて調査する必要があるとの内容であると推定
サブシステム
調査項目
品質
①組織②医薬品製品標準書、医薬部外品製品標準書③文書管理(データインテグリティ(以下「DI」)を含む)④出荷管理⑤変更管理⑥
逸脱管理⑦品質情報・品質不良(苦情)⑧自己点検⑨回収処理⑩GMP教育訓練⑪製造販売業者との合意事項(承認事項を含む。)
の遵守⑫品質方針・品質目標⑬品質マニュアル⑭製品品質の照査⑮是正措置・予防措置⑯原材料等の供給者管理⑰製造業者等(責任
役員)の責任⑱マネジメントレビュー・内部の情報伝達・資源の配分⑲技術移転⑳品質リスクマネジメント㉑外部委託業者管理
構造設備
①手順書・記録書(DIを含む)②図面管理③建屋・施設(作業室含む)及び設備と適格性確認(製造用水・製造設備・空調設備)建物
及び施設④設備・機器管理(メンテナンス)⑤コンピュータ管理⑥校正⑦製造用水管理⑧空調管理⑨遮光管理⑩出入り口管理⑪構造躯体
管理⑫衛生管理⑬防虫・防そ管理⑭交叉汚染の防止⑮封じ込め措置
製品原料
資材保管等
①手順書・記録書(DIを含む)②受け入れ管理③区分保管管理④表示管理⑤出納管理⑥不合格品管理⑦施設及び設備の適格性確認
⑧設備・機器管理⑨校正⑩衛生管理⑪環境管理⑫防虫・防そ管理⑬出荷作業⑭教育訓練
製造
(一般)
①手順書類②製造指図書・記録書管理(DIを含む)③作業前確認④工程管理⑤異物混入・汚染・混同防止⑥設備・機器管理⑦校正⑧
動線⑨ゾーニング(区分)⑩防虫・防そ管理⑪作業着管理⑫衛生管理⑬環境管理⑭微生物学的モニタリング⑮バリデーション⑯教育訓練
包装表示
①手順書・記録書(DIを含む)②作業前確認③表示材料管理④工程管理⑤汚染・混同防止⑥施設及び設備の適格性確認⑦設備・機器
管理⑧校正⑨衛生管理⑩作業着管理⑪動線⑫ゾーニング(区分)⑬防虫・防そ管理⑭環境管理⑮バリデーション⑯教育訓練
試験検査
①手順書・記録書(DIを含む)②検体採取③施設及び設備の管理④設備・機器管理⑤校正⑥試薬・試液・標準品管理⑦試験用水管理
⑧試験動物管理⑨試験検査結果判定・逸脱管理⑩合格ラベル・情報管理⑪参考品・保存品管理⑫衛生管理⑬安定性モニタリング⑭バリ
デーション(分析法バリデーション)⑮委託試験管理⑯教育訓練⑰試験室環境管理⑱微生物試験管理⑲無菌試験管理
出所:厚生労働省 GMP調査要領の制定について
*:GMP調査要領においては、適合性調査及び立入検査等の総称として「GMP調査」の名称が使用されている
31