よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
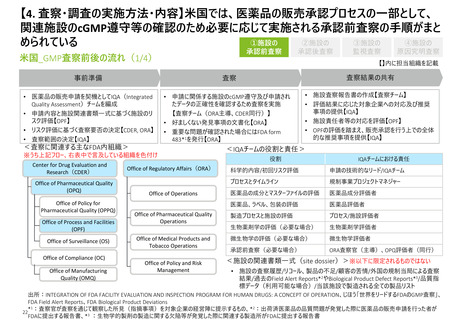
【4. 査察・調査の実施方法・内容】米国の承認前査察では、商業用の製造に対する準備、
申請内容に対する適合性、データインテグリティ監査が主な観点である
米国_査察の観点(1/2)
①施設の
承認前査察
②施設の
承認後査察
③施設の
監視査察
④施設の
原因究明査察
※②施設の承認後査察の特有の観点については現時点で情報が確認できていない
◼ 承認前査察においては大きく以下の3つの観点で査察を実施する
観点
内容
商業用の製造に
対する準備
◼ 施設及び商業用の製造に関するオペレーションを十分にコントロールできるよう設計された品質システムを有しているかを判断する
(確認の観点)
• 製造や試験室に関する変化や逸脱、原薬開発及び医薬品の製造に関連する傾向が十分に評価されている
• 原薬や製品のリリースを目的として、成分や加工中の原薬、完成品、容器、施栓系のサンプリング、試験、および評価のための健全で
適切なプログラム(サプライヤーの認定プログラムを含む)が確立されている
• 申請された製品の汚染や製品による汚染を防ぐために十分な施設と装置のコントロールが行われている
• バッチリリース、変化のコントロール、不具合・逸脱・苦情・有害事象の調査ための十分な手順が存在し、これらの情報についてFDAに報
告するための手順も存在する
• 指示、加工のパラメーター、工程管理の方法等を含むプロセスと製造バッチ記録が実行可能であり、科学的、客観的に正当である
申請内容に対する
適合性
◼ 製剤や製造、加工方法の検証を行う
◼ バッチ記録が申請におけるCMC(化学、製造、コントロール)セクションの記載と一致しているか確認を行う
データインテグリティ
監査
◼ 施設における、製品に関連する生データの監査と検証を行う
(この情報は特に、CDERの評価において、申請において提出されたデータの関連性、正確性、完全性、信頼性を確認するのに役立つ)
出所:FDA Drug Compliance Programs Preapproval Inspections
32
申請内容に対する適合性、データインテグリティ監査が主な観点である
米国_査察の観点(1/2)
①施設の
承認前査察
②施設の
承認後査察
③施設の
監視査察
④施設の
原因究明査察
※②施設の承認後査察の特有の観点については現時点で情報が確認できていない
◼ 承認前査察においては大きく以下の3つの観点で査察を実施する
観点
内容
商業用の製造に
対する準備
◼ 施設及び商業用の製造に関するオペレーションを十分にコントロールできるよう設計された品質システムを有しているかを判断する
(確認の観点)
• 製造や試験室に関する変化や逸脱、原薬開発及び医薬品の製造に関連する傾向が十分に評価されている
• 原薬や製品のリリースを目的として、成分や加工中の原薬、完成品、容器、施栓系のサンプリング、試験、および評価のための健全で
適切なプログラム(サプライヤーの認定プログラムを含む)が確立されている
• 申請された製品の汚染や製品による汚染を防ぐために十分な施設と装置のコントロールが行われている
• バッチリリース、変化のコントロール、不具合・逸脱・苦情・有害事象の調査ための十分な手順が存在し、これらの情報についてFDAに報
告するための手順も存在する
• 指示、加工のパラメーター、工程管理の方法等を含むプロセスと製造バッチ記録が実行可能であり、科学的、客観的に正当である
申請内容に対する
適合性
◼ 製剤や製造、加工方法の検証を行う
◼ バッチ記録が申請におけるCMC(化学、製造、コントロール)セクションの記載と一致しているか確認を行う
データインテグリティ
監査
◼ 施設における、製品に関連する生データの監査と検証を行う
(この情報は特に、CDERの評価において、申請において提出されたデータの関連性、正確性、完全性、信頼性を確認するのに役立つ)
出所:FDA Drug Compliance Programs Preapproval Inspections
32