よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
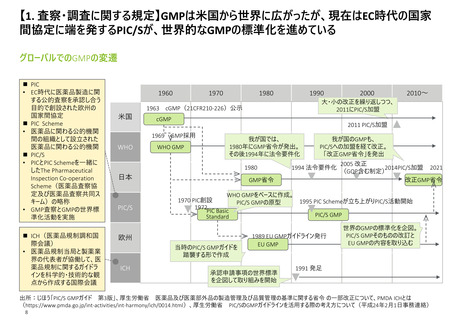
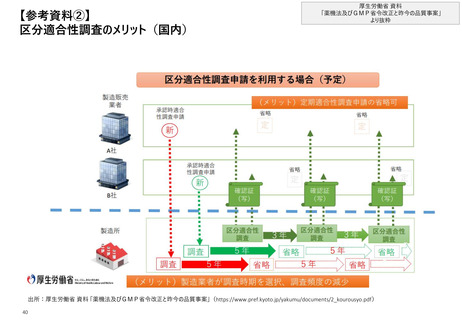
【1. 査察・調査に関する規定】加えて、根拠法令に基づいてGMPの要件を定めたガイドライ
ンや、調査員・査察官向けマニュアルが整備されている
日米欧におけるGMP遵守に関するガイドライン・マニュアル
日本
GMPに関する要件
を定めたガイドライン
等
調査員・査察官
向けマニュアル
米国
欧州
◼ 改正GMP省令
◼ 医薬品及び医薬部外品の製造管理及び
品質管理の基準に関する省令 の一部改
正について(令和3年4月28日、薬生監麻
発0428第2号)
(改正の経緯、逐条解説等)
◼ Code of Federal Regulations Title 21
• Part 210(通則)
• Part 211 (最終製剤)
◼ EudraLex - Volume 4 - Good
Manufacturing Practice (GMP)
guidelines
◼ GMP 調査要領
(国内における調査権者間のGMP関連
業務の標準化を図る目的で制定された、
全ての調査権者に共通の調査体制、業務
の根拠及び業務の要領を示し、国内におけ
る調査権者間のGMP関連業務の標準化
を図るもの)
◼ FDA Compliance program
※FDAスタッフが特定のプログラム領域にお
いて計画を達成するのを助けるためガイダン
スとインストラクションを提供
◼ INTEGRATION OF FDA FACILITY
EVALUATION AND INSPECTION
PROGRAM FOR HUMAN DRUGS: A
CONCEPT OF OPERATION
※医薬品に関する施設評価と査察のオペ
レーションモデルをまとめたもの。評価、査察
に関わる複数部署がどのように機能するか
を示している
◼ The Compilation of Union Procedures
-Conduct of inspections of
Pharmaceutical manufacturers or
importers
※加盟国の、GMPおよびGDP査察官の間
における協働を促進するツールとしてまとめら
れたCompilation of Union Procedures
の一部として、GMP査察手順がまとめられ
ている
出所:改正GMP省令(2021年)、21 CFR、EudraLex - Volume 4 - Good Manufacturing Practice (GMP) guidelines Part I、PIC/S Publications、厚生労働省 医薬品及び医薬
部外品の製造管理及び品質管理の基準に関する省令 の一部改正について、薬生監麻発 0317 第5号 GMP 調査要領の制定について、FDA Drug Compliance Programs、FDA
INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 EMA Compilation of Union Procedures on
5
Inspections and Exchange of Information
ンや、調査員・査察官向けマニュアルが整備されている
日米欧におけるGMP遵守に関するガイドライン・マニュアル
日本
GMPに関する要件
を定めたガイドライン
等
調査員・査察官
向けマニュアル
米国
欧州
◼ 改正GMP省令
◼ 医薬品及び医薬部外品の製造管理及び
品質管理の基準に関する省令 の一部改
正について(令和3年4月28日、薬生監麻
発0428第2号)
(改正の経緯、逐条解説等)
◼ Code of Federal Regulations Title 21
• Part 210(通則)
• Part 211 (最終製剤)
◼ EudraLex - Volume 4 - Good
Manufacturing Practice (GMP)
guidelines
◼ GMP 調査要領
(国内における調査権者間のGMP関連
業務の標準化を図る目的で制定された、
全ての調査権者に共通の調査体制、業務
の根拠及び業務の要領を示し、国内におけ
る調査権者間のGMP関連業務の標準化
を図るもの)
◼ FDA Compliance program
※FDAスタッフが特定のプログラム領域にお
いて計画を達成するのを助けるためガイダン
スとインストラクションを提供
◼ INTEGRATION OF FDA FACILITY
EVALUATION AND INSPECTION
PROGRAM FOR HUMAN DRUGS: A
CONCEPT OF OPERATION
※医薬品に関する施設評価と査察のオペ
レーションモデルをまとめたもの。評価、査察
に関わる複数部署がどのように機能するか
を示している
◼ The Compilation of Union Procedures
-Conduct of inspections of
Pharmaceutical manufacturers or
importers
※加盟国の、GMPおよびGDP査察官の間
における協働を促進するツールとしてまとめら
れたCompilation of Union Procedures
の一部として、GMP査察手順がまとめられ
ている
出所:改正GMP省令(2021年)、21 CFR、EudraLex - Volume 4 - Good Manufacturing Practice (GMP) guidelines Part I、PIC/S Publications、厚生労働省 医薬品及び医薬
部外品の製造管理及び品質管理の基準に関する省令 の一部改正について、薬生監麻発 0317 第5号 GMP 調査要領の制定について、FDA Drug Compliance Programs、FDA
INTEGRATION OF FDA FACILITY EVALUATION AND INSPECTION PROGRAM FOR HUMAN DRUGS: A CONCEPT OF OPERATION、 EMA Compilation of Union Procedures on
5
Inspections and Exchange of Information