よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
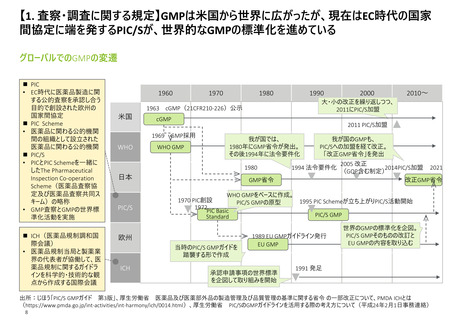
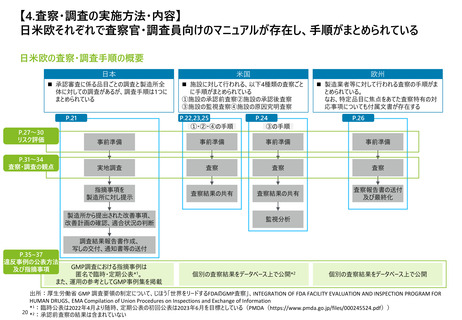
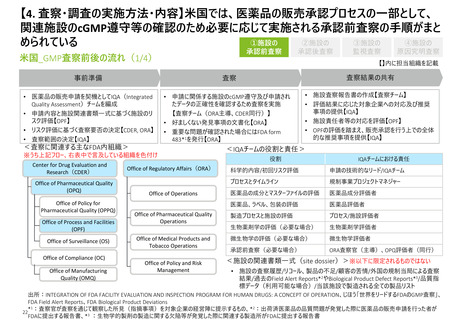
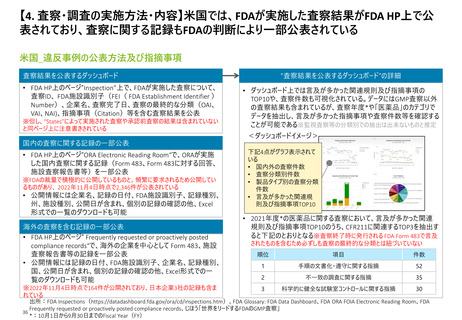
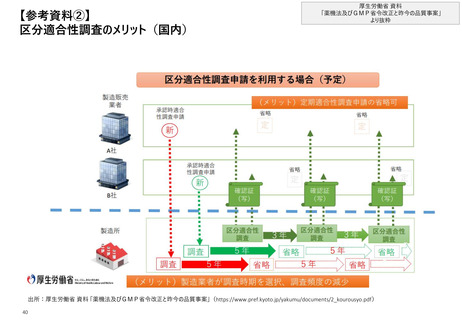
【2. 査察・調査の分類】日本では、実地で行われるGMP調査は、適合性調査・確認の一
部と立入検査等の2つに大別される
日本_実施契機に応じた分類
❶適合性調査・確認
GMP調査
※実地調査の頻度は1~3年
毎だが、リスクの高い製造所
については原則、年1回以上
の無通告調査を行う
• GMP省令に適合していると認められるかを確認するもので、以下の5種類から構成される
1. 製造販売承認前適合性調査
2. 製造販売承認後等適合性調査
3. 区分適合性調査
4. 変更計画に係る適合性確認
5.
輸出用医薬品等の製造に係る適合性調査
• 調査は、実地*(又は書面)で行われる
• なお、製造販売をしようとする際には、品目ごとに承認が必要であるが、承認後は製造業者からの申請に基づき、製造工程の
区分ごとの調査(区分適合性調査)を選択できる
➋立入検査等
• 以下の2種類から構成される
1. 通常検査:
定期的にGMP省令の規定を遵守していることを監視指導する
2. 特別検査:
予見できない事情等により、遵守状況を監視指導する必要がある場合に行う
改善内容確認、回収や苦情があった品目に係る製造所のGMP省令の遵守状況の確認、その他に区分される
• 調査は、原則無通告かつ実地で行われる
出所:厚生労働省 GMP 調査要領の制定について、じほう「PIC/S GMPガイド 第3版」
*:適合性調査・確認申請を受けた日から過去3年の間に当該製造所において実地のGMP調査を受けていない場合は原則実地調査
13
部と立入検査等の2つに大別される
日本_実施契機に応じた分類
❶適合性調査・確認
GMP調査
※実地調査の頻度は1~3年
毎だが、リスクの高い製造所
については原則、年1回以上
の無通告調査を行う
• GMP省令に適合していると認められるかを確認するもので、以下の5種類から構成される
1. 製造販売承認前適合性調査
2. 製造販売承認後等適合性調査
3. 区分適合性調査
4. 変更計画に係る適合性確認
5.
輸出用医薬品等の製造に係る適合性調査
• 調査は、実地*(又は書面)で行われる
• なお、製造販売をしようとする際には、品目ごとに承認が必要であるが、承認後は製造業者からの申請に基づき、製造工程の
区分ごとの調査(区分適合性調査)を選択できる
➋立入検査等
• 以下の2種類から構成される
1. 通常検査:
定期的にGMP省令の規定を遵守していることを監視指導する
2. 特別検査:
予見できない事情等により、遵守状況を監視指導する必要がある場合に行う
改善内容確認、回収や苦情があった品目に係る製造所のGMP省令の遵守状況の確認、その他に区分される
• 調査は、原則無通告かつ実地で行われる
出所:厚生労働省 GMP 調査要領の制定について、じほう「PIC/S GMPガイド 第3版」
*:適合性調査・確認申請を受けた日から過去3年の間に当該製造所において実地のGMP調査を受けていない場合は原則実地調査
13