よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
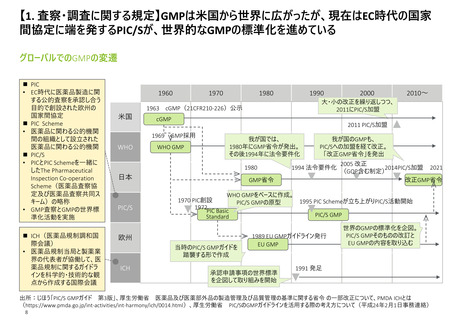
【1. 査察・調査に関する規定】
各国では、法律や規則、指令といったGMP遵守の根拠法令が存在する
日米欧におけるGMP遵守に関する根拠法令等
GMP遵守に関する
根拠法令
および言及箇所
日本
米国
欧州
◼ 薬機法
(医薬品、医療機器等の品質、有効性及び
安全性の確保などに関する法律)
<上記における言及箇所>
⇒ 第14条 医薬品の製造販売をしようとする者は、
品目ごとにその製造販売についての厚生労働
大臣の承認を受けなければならない
※第14条 第2項の各号に当たる場合、この承
認は与えられないとされている。
⇒ 第2項第4号:
申請に係る医薬品(中略)が政令で定め
られるものであるときは、そのものの製造所に
おける製造管理又は品質管理の方法が、
厚生労働省令で定める基準(=改正
GMP省令)にて適合していると認められな
いとき。
<GMP基準適合を証する基準確認証の交付を
受ける場合>
⇒ 第14条の2 第13条第1項の許可(=製造
業の許可)を受けようとする者(略)、第
13条の3第1項の認定(後述)を受けよう
とする者(略)は製造所における当該医薬
品等の製造管理又は品質管理の方法が
厚生労働省令で定める基準に適合してい
るかについて、厚生労働大臣に対し、製造
工程の区分ごとに確認を求めることができる
◼ USC
(United States Code、現行法律集)
<上記における言及箇所>
⇒ 21 USC 351 Adulterated drug and
devices
※下記(a)(2)(B) に該当する場合、
Adulterated drugとみなされる。
⇒ (a)(2)(B):
医薬品の製造、加工、包装または保
管(manufacture, processing,
packing, or holding)の方法等が
cGMP*1を遵守していない場合。
◼ CFR
(Code of Federal Regulations、連邦
規則集)
<上記における言及箇所>
⇒ 21 CFR Part 210:Part210、211、225、
226*2は、医薬品の製造、加工、包装ま
たは保管する際の方法、施設、管理方
法について最低限のcGMP要件を定めて
おり、これらを遵守できていない場合には、
501(a)(2)(B)のもと医薬品は不良品とみ
なされ、責任者は規制措置の対象となる
※501はUSC351を指す
◼ Directive 2001/83/EC(指令)
<上記における言及箇所>
⇒ Article 40 Paragraph 1 加盟国は自国
における医薬品の製造が、輸出用か否か
を問わず許可の対象であること(=製造
許可を受けること)を保証するため、あら
ゆる適切な措置を講じるものとする
⇒ Article 46 (f) 製造許可を受けた者は少
なくとも、医薬品に関してGMPの方針と
ガイドラインを遵守し、また、原薬のGMP
ガイドラインに従って製造された原薬のみ
を出発原料として使わなければならない
出所:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、United States Code、Code of Federal Regulations 、Directive 2001/83/EC、国立国会図書
館 アメリカ合衆国-法令、国立国会図書館 EU(欧州連合)-EU法について、じほう「PIC/S GMPガイド 第3版」、
*1:米国では自国のGMPをcGMP(current good manufacturing practice)と呼んでいる。資料によりCGMP、CGMPs等の表記もみられるが本資料ではcGMPに統一する
4 2
* :Part 225は薬用飼料、226は薬用物品に関する内容であり、いずれも動物用医薬品に関連する規則となっている
各国では、法律や規則、指令といったGMP遵守の根拠法令が存在する
日米欧におけるGMP遵守に関する根拠法令等
GMP遵守に関する
根拠法令
および言及箇所
日本
米国
欧州
◼ 薬機法
(医薬品、医療機器等の品質、有効性及び
安全性の確保などに関する法律)
<上記における言及箇所>
⇒ 第14条 医薬品の製造販売をしようとする者は、
品目ごとにその製造販売についての厚生労働
大臣の承認を受けなければならない
※第14条 第2項の各号に当たる場合、この承
認は与えられないとされている。
⇒ 第2項第4号:
申請に係る医薬品(中略)が政令で定め
られるものであるときは、そのものの製造所に
おける製造管理又は品質管理の方法が、
厚生労働省令で定める基準(=改正
GMP省令)にて適合していると認められな
いとき。
<GMP基準適合を証する基準確認証の交付を
受ける場合>
⇒ 第14条の2 第13条第1項の許可(=製造
業の許可)を受けようとする者(略)、第
13条の3第1項の認定(後述)を受けよう
とする者(略)は製造所における当該医薬
品等の製造管理又は品質管理の方法が
厚生労働省令で定める基準に適合してい
るかについて、厚生労働大臣に対し、製造
工程の区分ごとに確認を求めることができる
◼ USC
(United States Code、現行法律集)
<上記における言及箇所>
⇒ 21 USC 351 Adulterated drug and
devices
※下記(a)(2)(B) に該当する場合、
Adulterated drugとみなされる。
⇒ (a)(2)(B):
医薬品の製造、加工、包装または保
管(manufacture, processing,
packing, or holding)の方法等が
cGMP*1を遵守していない場合。
◼ CFR
(Code of Federal Regulations、連邦
規則集)
<上記における言及箇所>
⇒ 21 CFR Part 210:Part210、211、225、
226*2は、医薬品の製造、加工、包装ま
たは保管する際の方法、施設、管理方
法について最低限のcGMP要件を定めて
おり、これらを遵守できていない場合には、
501(a)(2)(B)のもと医薬品は不良品とみ
なされ、責任者は規制措置の対象となる
※501はUSC351を指す
◼ Directive 2001/83/EC(指令)
<上記における言及箇所>
⇒ Article 40 Paragraph 1 加盟国は自国
における医薬品の製造が、輸出用か否か
を問わず許可の対象であること(=製造
許可を受けること)を保証するため、あら
ゆる適切な措置を講じるものとする
⇒ Article 46 (f) 製造許可を受けた者は少
なくとも、医薬品に関してGMPの方針と
ガイドラインを遵守し、また、原薬のGMP
ガイドラインに従って製造された原薬のみ
を出発原料として使わなければならない
出所:医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律、United States Code、Code of Federal Regulations 、Directive 2001/83/EC、国立国会図書
館 アメリカ合衆国-法令、国立国会図書館 EU(欧州連合)-EU法について、じほう「PIC/S GMPガイド 第3版」、
*1:米国では自国のGMPをcGMP(current good manufacturing practice)と呼んでいる。資料によりCGMP、CGMPs等の表記もみられるが本資料ではcGMPに統一する
4 2
* :Part 225は薬用飼料、226は薬用物品に関する内容であり、いずれも動物用医薬品に関連する規則となっている