よむ、つかう、まなぶ。
【資料3】日米欧における医薬品の品質管理・製造管理に関する調査の状況(令和4年度欧米の薬事制度に関する調査・整理業務 調査結果) (36 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
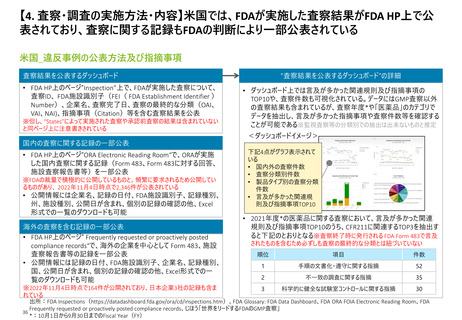
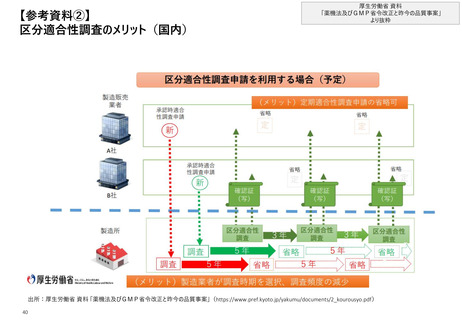
【4. 査察・調査の実施方法・内容】米国では、FDAが実施した査察結果がFDA HP上で公
表されており、査察に関する記録もFDAの判断により一部公表されている
米国_違反事例の公表方法及び指摘事項
査察結果を公表するダッシュボード
• FDA HP上のページ”Inspection”上で、FDAが実施した査察について、
査察ID、 FDA施設識別子(FEI( FDA Establishment Identifier )
Number)、企業名、査察完了日、査察の最終的な分類(OAI、
VAI、NAI)、指摘事項(Citation)等を含む査察結果を公表
※但し、“States”によって実施された査察や承認前査察の結果は含まれていない
と同ページ上に注意書きされている
“査察結果を公表するダッシュボード”の詳細
• ダッシュボード上では言及が多かった関連規則及び指摘事項の
TOP10や、査察件数も可視化されている。データにはGMP査察以外
の査察結果も含まれているが、査察年度*や「医薬品」のカテゴリで
データを抽出し、言及が多かった指摘事項や査察件数等を確認する
ことが可能である※監視査察等の分類別での抽出は出来ないものと推定
<ダッシュボードイメージ>
国内の査察に関する記録の一部公表
• FDA HP上のページ”ORA Electronic Reading Room“で、ORAが実施
した国内査察に関する記録(Form 483、Form 483に対する回答、
施設査察報告書等)を一部公表
※FDAの裁量で積極的に公開しているものと、頻繁に要求されるため公開してい
るものがあり、 2022年11月4日時点で2,346件が公表されている
• 公開情報には企業名、記録の日付、FDA施設識別子、記録種別、
州、施設種別、公開日が含まれ、個別の記録の確認の他、Excel
形式での一覧のダウンロードも可能
海外の査察を含む記録の一部公表
• FDA HP上のページ” Frequently requested or proactively posted
compliance records“で、海外の企業を中心として Form 483、施設
査察報告書等の記録を一部公表
• 公開情報には記録の日付、FDA施設識別子、企業名、記録種別、
国、公開日が含まれ、個別の記録の確認の他、Excel形式での一
覧のダウンロードも可能
※2022年11月4日時点で164件が公開されており、日本企業3社の記録も含ま
れている
下記4点がグラフ表示されて
いる
• 国内外の査察件数
• 査察分類別件数
• 製品タイプ別の査察分類
件数
• 言及が多かった関連規
則及び指摘事項TOP10
• 2021年度*の医薬品に関する査察において、言及が多かった関連
規則及び指摘事項TOP10のうち、CFR211に関連するTOP3を抽出す
ると下記のとおりとなる※査察終了時に発行される FDA Form 483で言及
されたものを含むため必ずしも査察の最終的な分類とは紐づいていない
順位
項目
件数
1
手順の文書化・遵守に関する指摘
52
2
不一致の調査に関する指摘
35
3
科学的に健全な試験室コントロールに関する指摘
30
出所:FDA Inspections(https://datadashboard.fda.gov/ora/cd/inspections.htm)、FDA Glossary: FDA Data Dashboard、FDA ORA FOIA Electronic Reading Room、FDA
Frequently requested or proactively posted compliance records、じほう「世界をリードするFDAのGMP査察」
36
*:10月1日から9月30日までのFiscal Year(FY)
表されており、査察に関する記録もFDAの判断により一部公表されている
米国_違反事例の公表方法及び指摘事項
査察結果を公表するダッシュボード
• FDA HP上のページ”Inspection”上で、FDAが実施した査察について、
査察ID、 FDA施設識別子(FEI( FDA Establishment Identifier )
Number)、企業名、査察完了日、査察の最終的な分類(OAI、
VAI、NAI)、指摘事項(Citation)等を含む査察結果を公表
※但し、“States”によって実施された査察や承認前査察の結果は含まれていない
と同ページ上に注意書きされている
“査察結果を公表するダッシュボード”の詳細
• ダッシュボード上では言及が多かった関連規則及び指摘事項の
TOP10や、査察件数も可視化されている。データにはGMP査察以外
の査察結果も含まれているが、査察年度*や「医薬品」のカテゴリで
データを抽出し、言及が多かった指摘事項や査察件数等を確認する
ことが可能である※監視査察等の分類別での抽出は出来ないものと推定
<ダッシュボードイメージ>
国内の査察に関する記録の一部公表
• FDA HP上のページ”ORA Electronic Reading Room“で、ORAが実施
した国内査察に関する記録(Form 483、Form 483に対する回答、
施設査察報告書等)を一部公表
※FDAの裁量で積極的に公開しているものと、頻繁に要求されるため公開してい
るものがあり、 2022年11月4日時点で2,346件が公表されている
• 公開情報には企業名、記録の日付、FDA施設識別子、記録種別、
州、施設種別、公開日が含まれ、個別の記録の確認の他、Excel
形式での一覧のダウンロードも可能
海外の査察を含む記録の一部公表
• FDA HP上のページ” Frequently requested or proactively posted
compliance records“で、海外の企業を中心として Form 483、施設
査察報告書等の記録を一部公表
• 公開情報には記録の日付、FDA施設識別子、企業名、記録種別、
国、公開日が含まれ、個別の記録の確認の他、Excel形式での一
覧のダウンロードも可能
※2022年11月4日時点で164件が公開されており、日本企業3社の記録も含ま
れている
下記4点がグラフ表示されて
いる
• 国内外の査察件数
• 査察分類別件数
• 製品タイプ別の査察分類
件数
• 言及が多かった関連規
則及び指摘事項TOP10
• 2021年度*の医薬品に関する査察において、言及が多かった関連
規則及び指摘事項TOP10のうち、CFR211に関連するTOP3を抽出す
ると下記のとおりとなる※査察終了時に発行される FDA Form 483で言及
されたものを含むため必ずしも査察の最終的な分類とは紐づいていない
順位
項目
件数
1
手順の文書化・遵守に関する指摘
52
2
不一致の調査に関する指摘
35
3
科学的に健全な試験室コントロールに関する指摘
30
出所:FDA Inspections(https://datadashboard.fda.gov/ora/cd/inspections.htm)、FDA Glossary: FDA Data Dashboard、FDA ORA FOIA Electronic Reading Room、FDA
Frequently requested or proactively posted compliance records、じほう「世界をリードするFDAのGMP査察」
36
*:10月1日から9月30日までのFiscal Year(FY)